これほどまでに新型コロナウイルスが全世界に未曾有の大惨事をもたらすと、たった数ヶ月前に誰が予想しただろう? これほどまでに科学や医学を発展させてきた人類が、RNA1本にトゲトゲ蛋白質の殻を被っただけの、生き物の風上にも置けない高分子野郎に、完膚無きまでに打ちのめされなければいけないのか? 〜これが俗っぽいが私の正直な印象だ。先日の鈴木勉会長の緊急メッセージを受けて、古市泰宏先生が、新型コロナウイルスに関して素晴らしい啓蒙書を書いてくださった。ウイルス学には疎い私が知らないことも多く、とてもいい勉強になった。また国立がんセンターの増富健吉先生は、臨床医として勇気を持ってPCR検査の検証研究を提案されている。頭が下がる思いである。うちの研究室スタッフの一人も、さっそく増富先生に連絡し、アメリカでの貴重な情報を提供してくれた。恥ずかしながら、一介のRNA基礎研究者である私にできることは何か? と問われれば、正直、今は何もできない。とりあえずは、Stay homeの大号令で、実験がまったくできない若手研究者のストレス解消に、このエッセーを面白おかしく読んでもらうことぐらいだろうか・・・。
たかが科研費、されど科研費
このエッセーを毎年秋に寄稿して2回になる (第1回、第2回)。これが予想以上に好評で、多くの方々から次を読みたいと言われながら、定期の昨秋には寄稿できず、担当者の甲斐田大輔さんに頼んで、半年延期させてもらった。タイトルの数字は、実際には、毎年1つずつ増えているが、気にしないでいただきたい。言い訳はよくないが、実は科研費応募の準備で大わらわだったのだ。科研費は、研究者にとって重要だから許されるだろうという、いけない腹づもりだ。さて、今年度の科研費を採択された人、採択されなかった人、悲喜こもごものことと思う。何を隠そう、私は2期、8年間ありがたく頂戴していた「基盤研究(B)」が途絶え、「悲」の方だった。あれほど全身全霊を傾け、推敲に推敲を重ねて書いたのに、落胆の極みだ。しかし採否の決定は、応募者がコントロールできるものではないから、くよくよ考えても時間の無駄だ。さっさと「悲」は忘れて、先に進もうではないか! このあたりの雑談から始めるとしよう。
うちの大学 (藤田医科大学) では、昨年から科研費取得の向上をめざして、科研費アドバイザー (指導者) 制度ができた。聞くところによれば、国立大学では、このような制度を採用しているところが多く、うちの大学は、どうやら後発らしい。科研費を応募する若手研究者の求めに応じて、科研費獲得の経験が豊富な教授が、書き方のアドバイスをするという制度だ。不採択がしょっちゅうの私も、恥ずかしながら基礎医学領域でのアドバイザーの担当を依頼され引き受けた。
昨年8月にその説明会があり、うちの研究所の所長となられた、貝淵弘三先生の的を射たお話が面白かった。曰く、「サイエンスは世界で一番、オリンピックで言えば金メダルでないといけない、銀メダルも、銅メダルもない。そういう意味では大変厳しい世界である」。なるほど、おっしゃる通りで、サイエンスの成果に二番煎じはあり得ない。当然、学会年会での発表や論文で公開される結果は、真新しいぴかぴかのオリジナルである。〜そう考えれば、どの科学的成果も、確かに世界で一番に違いない。しかし、このようなことを言うと、若い人は萎縮し、近ごろさっぱり人気のない研究職が、ますます敬遠されそうだ。世界一の成果を出すなんて、とてもそんな才能ないわぁ〜、となるだろう。私は、もう一つの事実を付け加えておきたい。新型コロナウイルスの大流行で来年に延期となった東京オリンピックは33競技、321種目らしいので、金メダルも321個余だろう。ところが、サイエンスの種目は異常に多く、金メダルもやたらめったら多い! 一番でかい金メダルは、ノーベル賞の金メダルだ (ちなみにこれは本物の金メダルだそうで、一方オリンピックの金メダルは金が少々銀メダルに貼り付けてある代物だ)。一方、学位論文でも世界で最初、ちっぽけかもしれないけど金メダルに値するのだ。若い君たちが、つい先ごろ受理された論文でも、大した論文やない、と思っているかもしれないけど、(不正がなければ) 正々堂々の世界で一番ですぞ。どうですか〜、このように考えると、サイエンスはやり甲斐があるじゃないですか! 無尽蔵の種目から、自由に得意の種目を見つけて、何でもいい、どんな些細なことでも「新しい」ことを見つける。小さくとも世界一だ。これぞ研究者の醍醐味で、この「新しい」ことを世界で最初に見つけた喜びが、何ものにも代えがたいくらい快感であるから、どんな艱難辛苦も耐えられるんですよ〜 (ちょいと大袈裟ですが)。
論文もそこそこ出しているのに、なかなか科研費が取れないと悩んでいる若手研究者は多いだろう。その説明会での貝淵先生のお話は、お互い、長い研究道を歩んできた研究者として、至極共感できるものだった。科研費をはじめとする競争的資金を得る極意は、あえて技術だと言っておこう。採択、不採択を決めるのは数人の審査員であり、それは決して絶対的な評価ではない (ちなみに私は、ほとんど同じ文面の応募書を違う応募区分に出して「不採択」が「採択」になったことがある!)。相手はあくまでも審査員だけだ。応募者が、どんなに才能があって、いいサイエンスをやっていたとしても、審査員が、「おっ、これはなかなか面白そうだ」と最初に思わなければ、(限られた時間で沢山の応募書を読まされる審査員には) まともに読んでもらえないし、そうなれば、まず不採択に間違いなしだ。実際に科研費を審査した経験があればこそ、私はそう断言できる。審査員に、「おっ、これはなかなか面白そうだ」、と思わせるには書き方がある。論文の書き方と応募書の書き方は全く違う、と割り切った方がいい。研究者は根が真面目な人が多いから、論文を書くように事実に客観的に向き合い、地味に応募書を書く傾向にあるが、これだとなかなか、締切にせかされながら沢山読まされ、夜中に眠たい目をこすって読んでいる審査員の琴線に触れないのだ。そうです、書き方が上達して、アピールがうまくなると、琴線に触れ、真面目に読んでもらえ、結局、いい評価につながって、採択されるようになる。そういう意味では、この書き方の会得は受験勉強みたいなもの。思い出してください、賢いから、才能があるから、大学に入学できるのではないでしょう。入学試験で、いい点をとれるようにちゃんとトレーニングできた人が、入学できるのです。こう考えると、気が楽になりませんか? 才能に恵まれた若い人が、面白くないけど、ちょっとトレーニングすればいいだけのことです。〜と偉そうに言いつつも、教授にとっては科研費は、研究室運営するうえで死活問題であることは確かです。どこかで聞いたような言葉ですが、「たかが科研費、されど科研費!」。
自分は真実で真っ向勝負するサイエンスの世界が好きで、この世界にハマり込んだ。大したことがない成果で、大風呂敷を広げて大袈裟にアピールするなど、クソ食らえ、と内心では思っている。「好きこそ物の上手なれ」だから、当然アピールは不得意であった (過去形である)。しかし、プロの研究者なると、前回紹介したJim WatsonやBarbara McClintockのような天才でもない限り、業績をあげるため、研究費を獲得するため、就職するため、など、諸々の目的のために、自分をアピールするのが必要不可欠な技術となってくる。私の場合は、この研究者としての致命的な技術的欠点が、幸運にも、長いアメリカ留学によって訓練され、劇的に改善されたようだ。東洋には、「沈黙は金なり」という素晴らしい格言があるが、アメリカでは「沈黙はNothing」である。沈黙していては、何も伝わらないし、もちろん誰も察しようなんてしない。世界中の国から研究者が集まっているから、母国語は千差万別、背景の文化も多種多様、以心伝心はあり得ない。いわば外国人の皆様は超KY (空気が読めない) と思っていい。日本人からしたら、何でもいちいち全部説明しないといけないから、面倒千万だろう。日本人が海外に留学して、仕事であろうが、日常生活であろうが、何から何まで言わないと相手が動いてくれないから疲労困憊する話をよく聞くが、日本生まれの日本育ちだから無理もない。逆に、日本で、KYといじられている人、天然とか言われている人は、案外アメリカ向きかもしれない。相手もきちんといちいち説明してくれて、何も恥じることはないからねぇ。
ポスドクで留学したコールドスプリングハーバー研究所 (CSHL) では、In-house seminarという所内発表会があって、すべてのポスドクは、順繰りに当番となり、研究成果を、錚々たる先生たちの前で(もちろん英語で)発表しなければならなかった。最初は、スライド1枚1枚につき、しゃべる文章を書いて、何回も練習して、とにかく準備が大変だった (当時はもちろんパワーポイントはなく、事前にスライドを作って映写機で発表)。しかし、これを何度も繰り返しやらされているうちに、段々と慣れていって、発表が苦にならなくなっていった。まあ、海外留学の経験がある人なら、誰でも実感できることだが、3年くらい経つと、いちいち原稿を用意しなくても、何とか話せるようになっていった。5年くらい経つと、聴衆の反応を見ながら、臨機応変に工夫しながら話せるようになっていた。ちなみに10年ぐらいすると、英語で議論、口論している夢を見るようになる。話す英語は、いちいち日本語から訳されているのではなく、脳から直接英語で出てくるようになるのだ。
一方、書く方の極意は「猿まね」だ。論文は仕事上、嫌でも読まないといけないが、英米人の論文で、こう言いたい時は、こういう表現をするのだ、と一つ一つ覚えていき、自分で使っていくのだ。慣れていくと、自分の表現としてこなれていく。言うまでもないが、文法上の表現を「猿まね」するのであって、文章をそのまま「猿まね」したら「盗用」と定義された立派な不正行為だ。とにかく英語は、書いて書いて書きまくらないと上手にはならない。研究室として論文を早く仕上げたいのは当然で、最初から論文を書いてくださる先生もいらっしゃるだろう。そこは勇気を持って「最初の原稿だけは書かせてください」、と平身低頭で先生に直訴しよう。拙くてもいい、おそらく先生が書き換え、自分の文章は跡形もなくなるだろうが、それでもいい。とにかく自分で書くことしか上達の方法がない。書くにしろ、話すにしろ、英語で発表する能力は研究者にとって必須だが、もし上達したいと思うなら、(今はあまり人気のない) 海外留学することだ。どんなにお金を払って英語教室に通うより、手っ取り早く英語が上達すること請け合いである!
おっと、またしても海外留学の勧め、になってしまったようだ。そろそろ、本論の研究の話題に入ろう。こういう機会でもなければ、ほとんど見返すことがないだろう昔の実験ノートを引っ張り出してきた。
スプライシング促進因子としてのRNPS1の精製と同定
前回のエッセイは、遠位の3′スプライス部位の選択活性をSF7と名づけ (図1A)、生化学的精製で孤軍奮闘、因子の正体を暴いてみると、重要な因子であった、という気を持たせる言葉で締めた。この話題も、なかなか面白いので紹介してみたい。
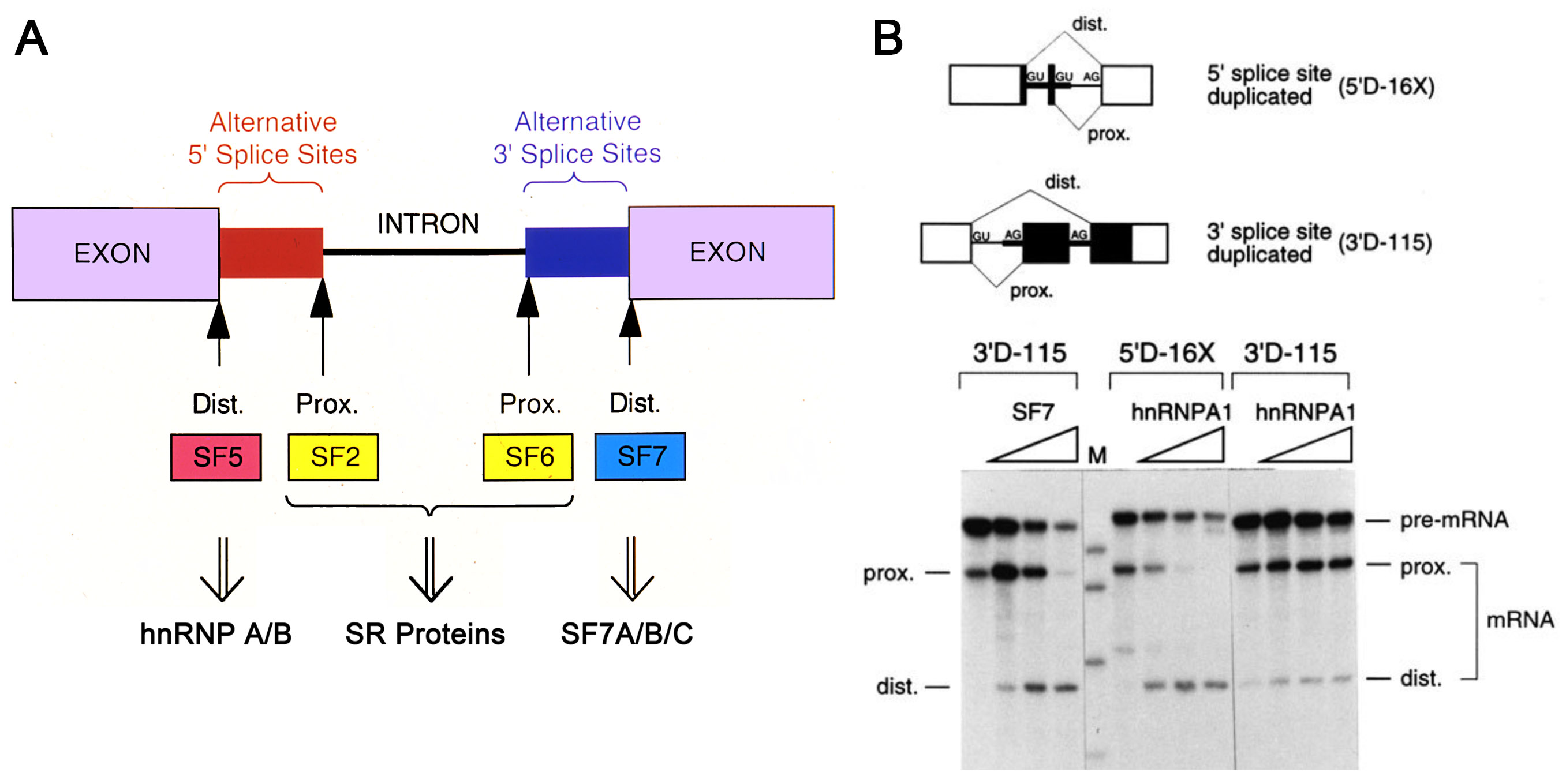
図1 (A) 選択的スプライシングを制御する活性と因子。以前の研究で、一部のSR蛋白質が近位の両スプライス部位の使用を促進し、hnRNP A/B蛋白質が、遠位の5′スプライス部位を促進することを明らかにした1,2。(B) hnRNP A/B蛋白質には、遠位の3′スプライス部位を選択活性 (SF7) はなく、HeLa細胞核抽出液の部分精製標品 (SF7-III、図2A、B参照) にその活性を認めた。その分画から、責任因子の精製・同定をすることが課題となった。論文3より改変して掲載。
hnRNP A1を同定した時と同様に、このSF7因子も遠位の3′スプライス部位の選択活性 (図1A、B) を指標に、今やまったくはやらない生化学的精製を遂行して同定に至った。この精製は、渡米した1年半後1991年9月27日には既に始めていて、SF7A因子 (図2A、B) として部分精製に至ったのが1994年12月4日だから、足掛け3年余りかかっている。もちろん、当時競争が激しくなっていったSR蛋白質、hnRNP A/B蛋白質の仕事と並行やっていたわけであるが、前に話したように活性を指標にした蛋白質の精製と同定は、暗中模索の連続。事前にプロトコールはなく、自分で試行錯誤しながら進めるので時間がかかるものだ。口頭発表なら、ここでTo make the long story short . . . と言うところだが、最終的に精製に成功した方法が、プロトコールとなるわけだ (図2A)。
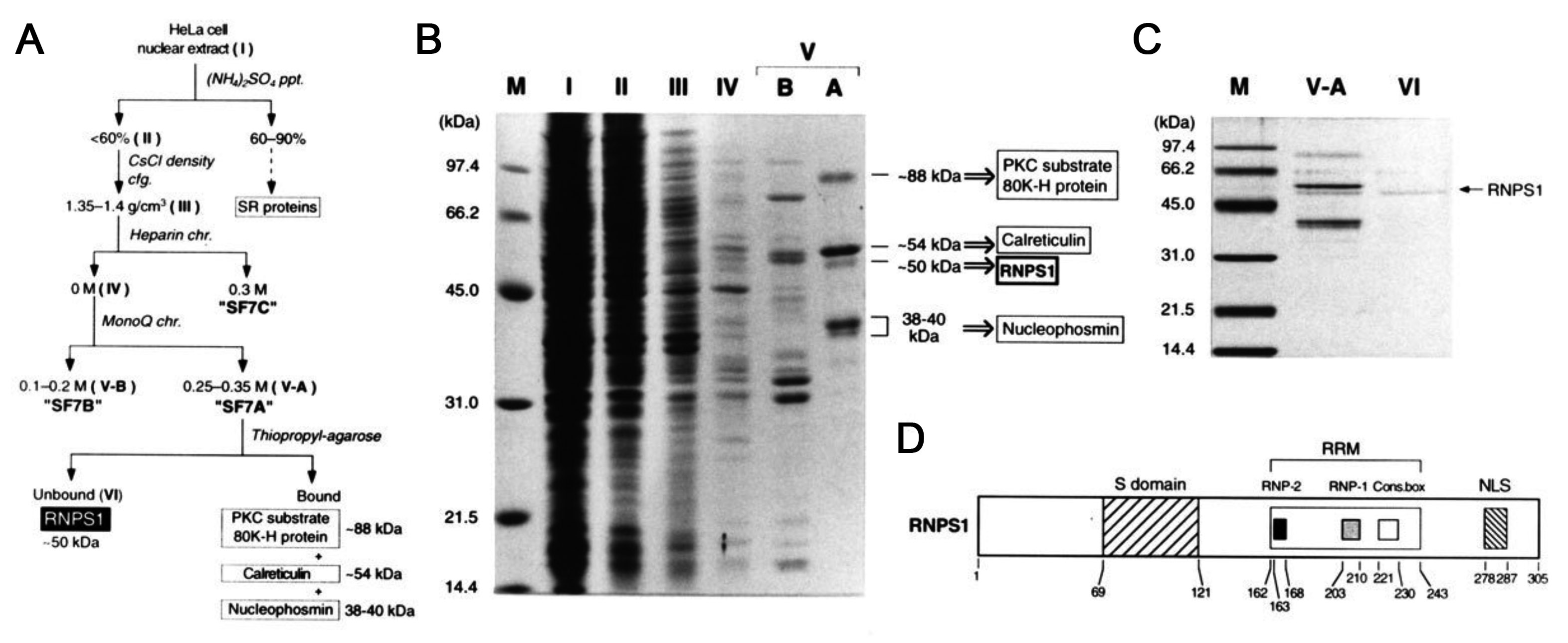
図2 (A) SF7活性 (遠位の3′スプライス部位の選択活性) の精製と蛋白質の同定。(B) 各精製分画のSDSポリアクリルアミドゲル電気泳動 (SDS-PAGE) での解析。(C) チオプロピル・アガロースを使ったRNPS1の単離。(D) RNPS1蛋白質の一次構造。RNA結合蛋白質が共有するRRMと、この蛋白質に特徴的なセリンに富んだS domainを有する。論文3より改変して掲載。
さて、精製したSF7A分画に存在した4つの蛋白質は、当時CSHLでプロテオミクスの研究室を持っておられた小林龍二さん (現、University of Texas, MD Anderson Cancer Center, Professor) にペプチド配列解析をしてもらった (図2B)。今や百人力の質量分析も、その当時は、まだ発展途上の状態でうまくいかなかった。年末に日本に帰省し、年が明けて帰米した1995年1月早々に朗報が待っていた。~50 kDaの蛋白質から読んだ一つのペプチド配列が、E5.1と名付けられたデータベース上の登録配列の一部に一致した (しかし論文はなかった)。さらに3ヶ月かけ、合計3つのペプチド配列で、完全に配列が一致したので決定だ。E5.1は、ヒトRNA結合蛋白質に特徴的な構造、すなわちRRM (RNA-recognition motif) を持っていた (図2D、当時はE5.1)。一方、他の3つの蛋白質も、解析したペプチド配列が既知の蛋白質と一致し、それらはスプライシングとは明らかに関係なさそうだった (図2B)。よって、この~50 kDaがどうも怪しい、すなわちSF7A因子の有力候補だ。奇妙なことに、配列から分子量を計算すると34.208 kDaなのに、SDS-PAGEではずっと大きい~50 kDaあたりに泳動された (図2B)。
すぐにデータベースへの提供者として記されたオーストラリアのEdith Gardinerに連絡すると、たいそう喜んで、今までその気がなかったのに、E5.1は新しいRNA結合蛋白質というだけで、そそくさと論文にした4。私もボスAdrian Krainerも、「どうぞ、どうぞ論文になさってください」、と悠然とどこ吹く風。なぜなら、こっちはもっと大きな発見をしようとしていたからだ。彼女の名誉のために言っておくと、決して性悪女ではなく、後日共同研究することとなり、窮地に陥ったときに救世主となった善人だ。さらに調べて見ると、このE5.1のマウスホモログと思われる蛋白質は、RNPS1と名づけられ、既に1993年報告されていた5。もちろん、このE5.1/RNPS1の機能などは全く知られておらず、最初の機能を発見しそうな私が有頂天になったのは言うまでもない。順番が前後するが最終的な命名は、ユニークな名前にしたい誘惑を断ち、最初のマウスホモログ報告者を尊重して、RNPS1にした。本来ならヒトのE5.1が該当するが、どう見ても様にならない名前だ。さらに、元のRNPS1の意味、RNA-binding protein prevalent during S phaseは、RNA-binding protein with serine-rich domainと読み直せて悪くはない。このRNA結合蛋白質には、非常に特徴的なセリンに富んだ領域 (S domainと命名) があるのだ (図2D)。さてRNA学会員の目ざとい諸君ならば、ここで、あれっ、RNPS1はExon-junction complex (EJC) がらみの因子じゃないの、と気づかれるだろう。まさに正解で、RNPS1は、私たちがスプライシング活性化因子として同定した後、EJCの表層因子として再発見された。奇縁であるが、後日、スプライシング因子としてのRNPS1とEJC表層因子としてのRNPS1が、劇的な邂逅を遂げるのだ。この話題については、また後に解説する機会があるだろう。
やっと尻尾をつかんだRNPS1、てっとり早くSF7A分画を大量にSDSゲルに流し、この怪しい~50 kDaの部分からRNPS1蛋白質を溶出させて選択的スプライシングを調べたが、収量も悪く、情けないほどの活性しか観察できなかった。人間、楽をしようとするとろくなことはない。やはり、何とかして、SF7A分画から、このRNPS1だけを個別に精製しないといけない。ある時、Adrianとあれこれ、どうしようかと議論していると、RNPS1のアミノ酸配列にシステイン残基が全くないことに気づいた。チオール基に結合するチオプロピル・アガロースを使えば、うまく分離できるかも、という話になった。これが見事に大当たり! 試してみると、他の3つの蛋白質がすべて、このチオプロピル・アガロースに結合、上清にはRNPS1だけが残った (図2C)。こうして、めでたく5月1日にRNPS1の均質精製 (purified to homogeneityと言うのは古典的生化学者の名誉) が完了したが、研究はそこで終わりではない。
次は、もちろんこの単離したRNPS1にSF7活性があることを厳密に証明しないといけない。これが、予想以上に大変で、さらに悪戦苦闘を2年も強いられ、満足なデータが揃ったのが、精製を始めて5年半余り経った1997年5月15日のことだった。何とも悠長な話だ。ボスがLynne Maquatなら、しびれ切らしてとっくにお蔵入りした仕事だろう (一部にしか受けない冗談ですみません)。要するに、単離したRNPS1になかなか強いSF7活性を示せなかったのである。当然、SF7BやSF7C分画 (図2A) に必要な因子が分離しているかもしれない可能性も徹底検討したが、うまくいかなかった。そこでリコンビナント蛋白質を作って十分濃度のRNPS1を調製するために、SF2/ASF (SRSF1) やhnRNP A1で成功した経験から、大腸菌で発現させてリコンビナントRNPS1蛋白質を作った。奇妙なことにSDSゲル上の移動度が~50 kDaより下の~42 kDaの位置に現れ、その上、まったくSF7活性がなくてガックリと落胆した (図3A、B)。途中で切れた部分蛋白質を疑い、ペプチド配列解析までしたが完全長だった。ただ、面白いことに気がついた。サイエンスでは転んでもただでは起きないことが大事だ。RNPS1蛋白質は修飾されていて、その修飾が活性に必要ではないだろうか、と閃いた。そこで、翻訳後修飾が期待できるバキュロウイルス感染昆虫細胞を使ってリコンビナント蛋白質を作ることを考えた。ありがたいことに、例のちゃっかり論文のGardiner研の筆頭著者のJosephが、快くこの仕事を買って出てくれ、リコンビナントRNPS1を発現させた昆虫細胞をドライアイス詰めで送ってきてくれた。そこからリコンビナントRNPS1を調製してみると、案の定、精製したヒトRNPS1と全く同じ~50 kDaの移動度を示し、さらに、めっぽう強いSF7活性があったのだ (図3B)。感激もひとしお、これですべてつじつまが合い、万々歳! 何の修飾かはわからなかったが、SF7活性のためには、RNPS1蛋白質の修飾が必要だったのだ。ブレークスルーをもたらしてくれたGardiner研がありがたかった。この時ばかりは「情けは人のためならず」と言う格言が身にしみた。
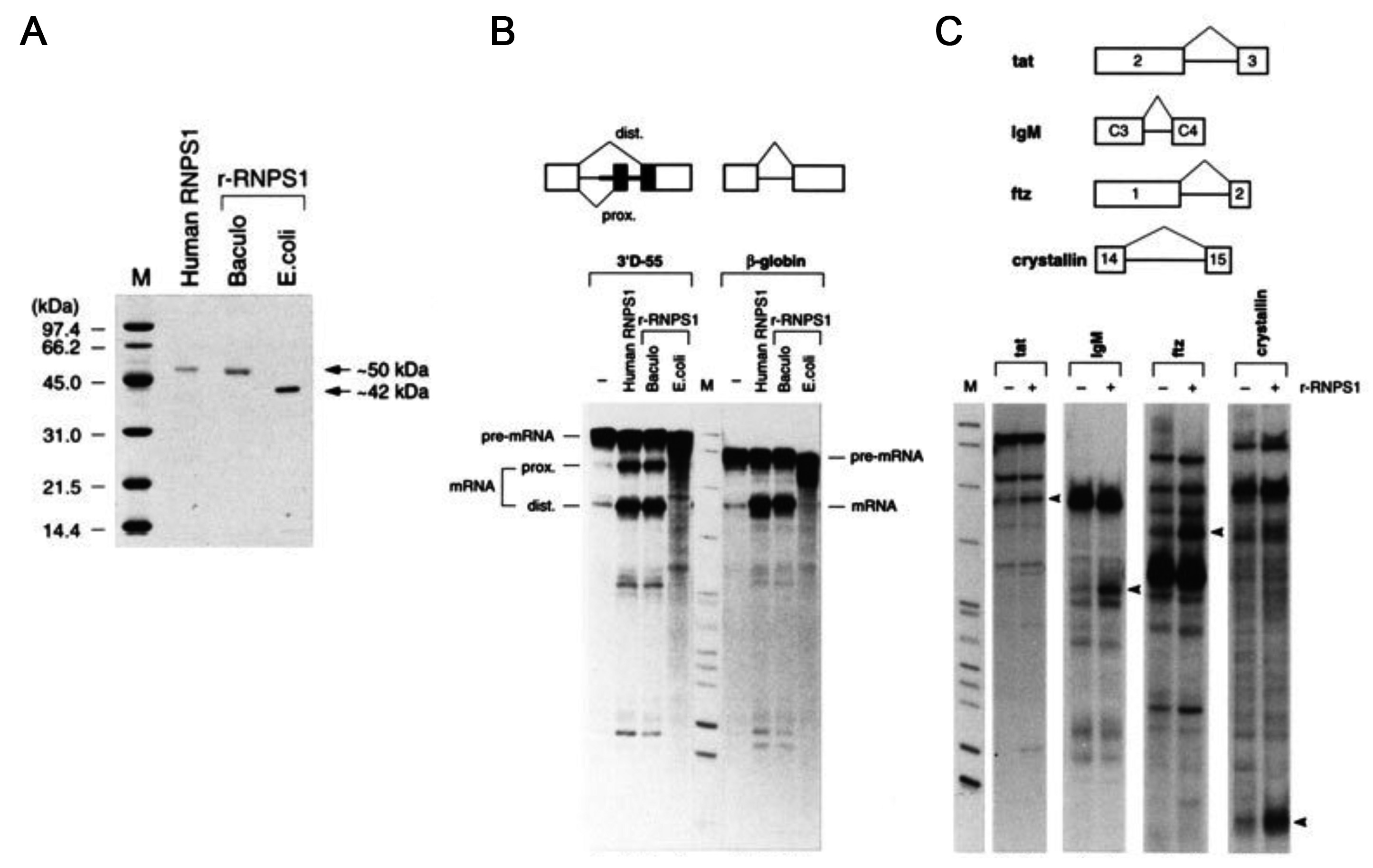
図3 (A) 精製したヒトRNPS1蛋白質と大腸菌、バキュロウイルスで発現したリコンビナントRNPS1蛋白質のSDS-PAGE。大腸菌のリコンビナントRNPS1だけ移動度が違う。(B) 選択的スプライシング基質 (3′D-55) と恒常的スプライシング基質 (β-globin) を使ったin vitroスプライシング解析。RNPS1添加で、いずれのスプライス産物 (mRNA) も顕著に増加しているが、大腸菌のリコンビナントRNPS1には活性が全くない。(C) 4種類の恒常的スプライシング基質 (tat、IgM、ftz、crystallin) を使ったin vitroスプライシング解析。バキュロウイルス発現のリコンビナントRNPS1添加で、どのスプライス産物 (矢尻) も顕著に増加している。論文3より改変して掲載。
一方、in vitro選択的スプライシング解析で、予想外の結果が観察された。よく見ると、遠位3′スプライス部位からだけでなく、近位3′スプライス部位からのスプライス産物も、顕著に増えているではないか (図3B、3′D-55)! そこで、選択的スプライス部位のない元のβ-グロビンmRNA前駆体を用いると、これでもスプライス産物が著しく増加した。どうやら、スプライシングが全体的に促進しているようだ (図3B、β-globin)。部分精製品で観察されたSF7活性、すなわち近位3′スプライス部位から遠位3′スプライス部位へのスイッチとは、明らかに結果が違う (図1B)。なぜ部分精製品で見られた遠位3′スプライス部位選択活性が、そこから完全精製された標品の一つRNPS1では失われてしまったのか、という興味をそそる問題はさておき、これは非常に重要な因子の発見を予感させた。念のため、配列が全く違う4種類の恒常的スプライシング基質で調べても、すべてスプライシングが促進していることがわかった (図3C)。すなわち、精製したRNPS1蛋白質には、一般的にスプライシングを促進する活性があるのだ。
一つの発見を起点として、興味がどんどん湧き、次から次へと出てくる疑問を探求したくなるのが、健全な研究者の性だ。実際に次のような問題を解決すべく、継続的に実験を続けていた。(1) SF7B、SF7C因子の本体は何か?、(2) SF7A (RNPS1) 因子を用いて遠位3′スプライス部位活性の再構成 (SF7B、SF7Cの関与) ができるのか?、(3) RNPS1はスプライシング必須因子か?、(4) In vitro系で示したRNPS1のスプライシング促進活性は、in vivo系 (培養細胞) でも再現できるのか?、(5) スプライシング促進活性に必要なRNPS1の修飾は何か?、そして (6) RNPS1は、どのようなメカニズムでスプライシング促進するのか? しかしながら、すぐに期待する結果が出るものではなく、もちろん他の研究課題も並行してやっていたが、どんどん月日が流れていく。親方様Adrianは古典的生化学でもって世界初のヒトのスプライシング必須蛋白質因子SF2/ASF (SRSF1) を精製・同定した人なので、時間がかかるのは百も承知。相も変わらず「苦しゅうないぞ、良きにはからえ〜」と放任し、楽観している。ここらで自分の尻に自ら火をつけ、この革新的な結果を論文にまとめる方向で方針変換、必要最小限のデータ取りに集中した。1998年も開けて春になっていた。
さあ、どうするか。(1)~(4) は難航していたので、取りあえず棚上げしておく。(5)、(6) は重要だが、今回の論文には含めない (out of scopeという)。しかし、RNPS1を一般的なスプライシング促進因子 (splicing activator) として偉そうに報告するならば、何かしらそのメカニズムを示唆するようなデータがないと、上等の雑誌ではまず門前払い (Editorial reject) だ。いいネタがあった。SR蛋白質を欠いているS100抽出液にSR蛋白質を加えて行うin vitroスプライシング系があるが (初回の図9参照)、それを使って解析をすると、RNPS1は、少量のSF2/ASF (SRSF1、SR蛋白質の一つ) 存在下で、スプライシングが劇的に促進された。もちろんSF2/ASFがないとスプライシングされなかったので、SR蛋白質の代わりにはならない。RNPS1はSR蛋白質と相互作用してスプライシングを促進しているようだ (図4A)。細胞内局在を調べると、確かにスプライシング因子のSR蛋白質SC35 (SRSF2) と同様に、核内に斑点状 (Nuclear speckles) に局在している (図4B)。スプライシング因子なら、もちろん基質RNAとの結合が考えられるが、その証拠も免疫沈降によって得られた (図4C)。ここで、よく見るとRNPS1はmRNA前駆体だけではなく、スプライシングされたmRNAにもよく結合している。この当時はまだ発見されていないEJCの表層因子としてのRNPS1を反映しているに違いない。さて、RNPS1が一般的なスプライシング促進因子なら、当然のことながら種々の生物で、その因子が保存されて、ホモログが存在するはずだ。データベース調査から、そのホモログ候補配列を挙げることができた (図4D)。やりたいことは多々あったが、取りあえずデータを揃え、いよいよ論文としての格好がついたところで論文執筆に集中した。

図4 (A) SR蛋白質を欠くS100抽出液を用いたin vitroスプライシング。少量のSF2/ASF (SRSF1) 存在下でRNPS1が著しくスプライシングを促進している。(B) RNPS1とhnRNPA1のHeLa細胞内での局在。(a, d) 一過性に発現させたT7タグ付き蛋白質の抗-T7タグ抗体による検出。(b, e) 内在性SC35 (SRSF2) の抗-SC35抗体による検出。(c, f) a, bとd, eを重ね合わせた画像。黄色のイメージが共局在を現す。(C) In vitroスプライシング反応液の免疫沈降物のRNA解析。RNPS1はmRNA前駆体とスプライスされたmRNAに結合している。(D) 当時のデータベース上に存在したRNPS1ホモログ候補とのアミノ酸配列比較。Hum:ヒト、Mou:マウス、Rat:ラット、Fis:ゼブラフィッシュ、Fly:ショウジョウバエ、Nem:線虫。論文3より改変して掲載。
プロ研究者の最大かつ永遠のジレンマは、一流雑誌に論文を出すことにこだわると、なかなか論文が出ないことに尽きるだろう。極端な話、一発超弩級の論文を出したら、ノーベル賞につながるかもしれないけれど、そのために10年間、何も論文が出なかったら、まったく無能な研究者の烙印を押されるが落ちである。実際問題として、研究費も取れないだろうし、研究室も運営できなくなり廃業だろう。一方、有名雑誌に論文が出ていないと、いくらプロポーザルがすごくても、とてもじゃないが大きな研究費が取れないことも厳然たる事実だ。どの段階で論文をまとめて出すのかをうまく見極めることは、独立研究者としての腕の見せどころかもしれない。いい雑誌への発表が期待できる革新的な研究課題を、じっくり取り組みながらも、大学院生やポスドクのために、確実に結果がでそうな研究課題をも同時進行でやっていく。自分の研究室を持つようになったら、このようなバランスの取れた取り組みをやっていかないといけない。大きな研究費を取って、人をいっぱい雇い、論文を大量生産しているような研究室を羨ましく思わない方がいい。どこかで聞いたような言葉だがGoing my wayでいいのだ (まさに自戒の念を込めて・・・)。研究員が数人の小規模な実験系の研究室なら、真摯に取り組んだオリジナル論文が1年に1、2報が確実に出ていれば御の字だろう。大きな科研費をとるのは、歌手じゃないけど、ヒット曲ならぬ、ヒット論文がでないと、なかなか難しい。さりとて、ヒットを狙ってヒット曲が出るわけはない。サイエンスは、Going my way (我が道を行く) が一番! つい先日、西倉和子先生が会報に寄稿してくださったエッセーを、もしまだなら是非とも読んでほしい。ご自身の興味である「RNA編集」一筋に、まさにGoing my wayでOnly oneを追求され、競争の激しいアメリカで成功を収められた。これぞ一流研究者の生きた証言である。
洋の東西を問う〜師匠と愛弟子か? ボスとポスドク従業員か?
前回話したように、研究環境が最高のCSHLにポスドクとして身を置き、運良くおおらかで優しいボスに巡り会い、タイムリーな課題でもって存分に研究できたわけで、誠に恐悦至極にございます〜となって、ついつい長居を決め込んでいた。私は彼の最初のポスドクだったが、後から雇われたアルゼンチン人とアメリカ人の後輩ポスドク2人は、論文が出て1、2年すると、そそくさと就職活動を始めるではないか。危機感みなぎり、早く独立したい気持ち満々の雰囲気の中に身を置くと、ポスドク生活を謳歌していた私も、不思議なもので何となく自分も就職活動しないとやばいのかなぁ〜という気持ちになってくる。実際に、ポスドク4年目となった1993年の秋から独立研究者となるべく、大学を中心に応募を始めた。
応募を始める前のある日、Adrianから一緒に夕食にいかないか、と誘われた。食事をしながら、おもむろに「Akila知っているか、アメリカでポスドクをあまり長くやるとCV (履歴書) 上、あまり良くない。Post-doctoral FellowからStaff Associateにプロモーションしたい」と言う。Staff Associateというのは、独立ポストではなく、研究室に所属はするけれども、Post-doctoral Fellowよりずっと給料がいい上級ポストだった。当時の私はというと、好きな研究に没頭でき、成果も着実に出て、楽しくてしょうがない2, 6-11。それだけでも満足だったので、この過分な申し出には、ただただ恐縮するばかりだった。ただ冷静に考えると、私は1年目は、Long Island Biological Association (LIBA) から、2~3年目は中曽根首相肝煎で作られたばかりのHuman Frontier Science Program (HFSP) からフェローシップをもらっていたので、3年間Adrianは自分のグラントから私の給料には、びた一文お金を使っていなかった (アメリカでは、研究室で雇うポスドク、テクニシャン、大学院生の給料は、全部自分のグラントから支払う)。私は、「グラントから高い給料を出すくらいなら、若いポスドクを2人雇った方がいいんじゃないですか?」と進言すると、即座に「いやお前の働きはポスドク2人分だ」と答えた! そう言われて感謝感激したのは言うまでもないが、これは日本流のまさに義理人情の世界だ。アメリカ人なら見方が違う。より良いポストを提供して給料を上げるのは、就職して外に出て行くのをくい止めるためと考える。まだまだ戦力になるから、引き留めておきたいに違いないと思う。あくまでビジネスに徹した契約社会の話に過ぎないのだ。「ボスはポスドクを生かさず殺さずが極意」というひどいブラックジョークもあるほどだ。昨今は、多くの日本人プロ野球選手が、アメリカの大リーグに入り活躍しているが、彼らの契約、トレード、解雇、などを見てもらうと感覚的にわかると思う。すべてのことはビジネスと割り切ってドライに進められる。そこに感情や愛憎は一切持ち込まれない。このように言うと冷酷なようだが、人間関係が大事な日本よりも楽な面もある。恨み辛みが一切ないから、人間関係が苦手で辛い人は、きっとアメリカが向いている。
印象深い思い出がある。当時、日本人はポスドクとして留学するのが一般的だったが、中国人はほとんどの場合、自国の大学を卒業すると、大学院から留学し、学位を得てポスドクになり、そのまま出世してPI (研究室をもつ独立研究者) として研究室を持つ人も多い。大学院生から鍛えられるわけだから、英語もずっと日本人よりうまい。専門を同じくする私の友人Jane Wuは、超一流のStanford Universityで学位を取り、超一流のHarvard Universityでポスドクをやり、アメリカで成功して、今はNorthwestern Universityで教授として活躍しているが、RNA Society Meetingでポスター発表を見に来てくれたことがあった。内容は忘れたが、いい研究だと褒められた時、日本人そっくりの彼女の顔を見て思わず、「いやぁ〜、いい環境とボスAdrianのお陰で、いい研究させてもらっている・・・」と、ついつい日本人に戻ってしまい、謙遜気味の返答をしてしまった。そうすると、「Akila、それはすごくわかるけど、アメリカ社会では、それを言わない方がいいよ」と優しく諭してくれた。彼女は自分はアジア人だから、義理人情のことがよくわかると言う。だけど、アメリカの競争社会では、その美徳を前面に押し出すと、損をすることがあると、〜まさに「洋の東西を問う」指摘をしてくれたわけだ。確かに、アメリカ人の若い子のポスターに行って研究を褒めると、大袈裟に喜んで、「Thank you very much! Yes, I did a great job.」のような感じで得意満面、それはかわいくて憎めないが、日本では生意気な青二才で、まず好かれることはないだろう。ただ、その場では、誰のおかげ〜、云々という事情はあまり研究と関係ないのは確かだ。アメリカでは、余計なことは言わない、Straight forward (単刀直入) が一番だ。
アメリカ生活が長くなるにつれ、いろいろと「洋の東西を問う」勉強をさせていただいたが、ボスのAdrianとはあまりビジネスライクに付き合わなかった。彼は日本映画が大好きで、私よりよく見ていて驚いた。とりわけ、今は亡き伊丹十三の映画のファンだった。変な話だが、「タンポポ」や「マルサの女」などで忘れられないシーンを日本人の私に説明してくれるのだ。「まだならぜひ見たらいいよ」と勧められてから、ビデオテープを借りて見たぐらいだ。「タンポポ」でラーメンをズルズルと派手に音を立てて食べるのが面白いと言う。「そうそう、日本では麺類は音を立てて、おいしそうに食べるのがマナー」と教えておいた。時代劇での義理人情の世界も、よく理解していて、なかなか心地いいらしい。あえて日本的人情でもって接すると、とても嬉しそうだった。私が帰国してからの話であるが、招待講演で来日したときに、「ホテルは世界中同じだから、つまらない。Akila、何か面白いところを手配してくれないか?」と言うものだから、手っ取り早く、名古屋の自宅に連れて、泊まってもらったことがあった。和室で布団を使って寝る作法、日本の風呂に入る流儀を、事細かく指南してあげると、興味津々、とてもエンジョイしていた。一番風呂は入った後は絶対に流さない、後で家族が入るからと言うと、恐縮して、「Hairが入ってもいいのか?」と聞いてくるから、「そんなものは日本ではNever mindだ」、と言ったけど、西洋人は昔は毛唐というぐらい毛むくじゃらだから、気になるのも無理もない、〜と思い直し妥協、「先に洗い場で体を洗ってから湯船に入ったらどう?」と勧めて合点、一件落着した。日本のラーメンが好きで、有名なラーメン屋に連れていった。注意深く、食べるところを観察していたが、気持ち悪いくらい無音で食べていた (これは日本人にはとても難しい技だ)。習い性となっている行動に学習効果はなかったようだ。
また随分話が脱線してしまった。食事に連れて行ってもらった話の続きだが、妙なことを言い出した。「Akilaは今後就職活動をするが、大事なことがあるから聞いてほしい。遅かれ早かれ独立して研究室を持つと思うけど、Krainer研でやっていた研究とdistinctな (ひと味違う) 研究テーマをやらないといけない」。これはどういう意味なのか。要するに、師匠から弟子が独立したら、(お互いのために) 弟子は師匠のライバルになってはいけないという掟である。もちろん、前回話したCarol Greider研のポスドクのように、アメリカでは超優秀でかつ闘争心の強い弟子も中にはいて、師匠と同じ分野で派手に業績を出しまくり、元恩師が立派になりすぎた元愛弟子をライバル視するに至るという、まことに滑稽な話もあるにはあるが、ごく少数派だ。大概は、弟子が同じ分野でも「ひと味違う」研究を始めて、以前のボスとは絶妙な距離を取りながら持ちつ持たれつで、お互いに業績を挙げていくものだ。
私がKrainer研のポスドクとして一緒にやってきたSR蛋白質とhnRNP A/B蛋白質が関与するスプライシング制御の一連の研究は2, 6-11、世界中の研究室がフォローするようになり、共同研究が申し込まれることも多々あった1, 12-20。まさにその分野のパイオニアとして、研究の最前線を突き進んでいるようで気分爽快であった。しかし、その成果はあくまでKrainer研のPIであるAdrian Krainerの業績であって、同じ方向で研究をやってもAkila Mayedaの評価につながらない、というわけだ。思い起こせば、確かに彼もボスだったTom Maniatis研にいた時から、in vitroスプライシングを使った基礎研究をやっていたけれど、CSHLに来てからは、同じスプライシング研究でも、ボスがやらなかった生化学的な精製をやり始めて、スプライシング必須因子SF2/ASF (SRSF1) の発見に至り、彼のPIとしての華々しいキャリアが始まったのだ。同様に、同じスプライシング研究でも、私自身が注目したSF7活性、その精製に苦心惨憺の末に成功し、7年後に一般的にスプライシングを促進する活性のあるスプライシング促進因子RNPS1の発見に至った成果が、独立後のMayeda 研の「ひと味違う」研究テーマの基盤となることは、さすがに暗黙の了解があった。
これですんなりと就職先を見つけてPIで独立すれば格好がつくところだが、人生、そうは甘くはない。今日この頃の新型コロナウイルス禍でちょくちょくテレビに出演されている山中伸弥先生のお部屋の額にも書いてあった「人間萬事塞翁馬」、次回はそんな話になりそうだ。
(続く)
参考文献
1. Fu, X.D., Mayeda, A., Maniatis, T. & Krainer, A.R. (1992). General splicing factors SF2 and SC35 have equivalent activities in vitro, and both affect alternative 5' and 3' splice site selection. Proc Natl Acad Sci USA. 89, 11224-11228.
2. Mayeda, A., Helfman, D.M. & Krainer, A.R. (1993). Modulation of exon skipping and inclusion by heterogeneous nuclear ribonucleoprotein A1 and pre-mRNA splicing factor SF2/ASF. Mol Cell Biol. 13, 2993-3001 [published erratum in 4458].
3. Mayeda, A., Badolato, J., Kobayashi, R., Zhang, M.Q., Gardiner, E.M. & Krainer, A.R. (1999). Purification and characterization of human RNPS1: a general activator of pre-mRNA splicing. EMBO J. 18, 4560-4570.
4. Badolato, J., Gardiner, E., Morrison, N. & Eisman, J. (1995). Identification and characterisation of a novel human RNA-binding protein. Gene. 166, 323-327.
5. Schmidt, G. & Werner, D. (1993). Sequence of a complete murine cDNA reflecting an S phase-prevalent transcript encoding a protein with two types of nucleic acid binding motifs. Biochim Biophys Acta. 1216, 317-320.
6. Krainer, A.R., Mayeda, A., Kozak, D. & Binns, G. (1991). Functional expression of cloned human splicing factor SF2: homology to RNA-binding proteins, U1 70K, and Drosophila splicing regulators. Cell. 66, 383-394.
7. Mayeda, A. & Krainer, A.R. (1992). Regulation of alternative pre-mRNA splicing by hnRNP A1 and splicing factor SF2. Cell. 68, 365-375.
8. Mayeda, A., Munroe, S.H., Cáceres, J.F. & Krainer, A.R. (1994). Function of conserved domains of hnRNP A1 and other hnRNP A/B proteins. EMBO J. 13, 5483-5495.
9. Hanamura, A., Cáceres, J.F., Mayeda, A., Franza, B.R., Jr. & Krainer, A.R. (1998). Regulated tissue-specific expression of antagonistic pre-mRNA splicing factors. RNA. 4, 430-444.
10. Mayeda, A., Munroe, S.H., Xu, R.M. & Krainer, A.R. (1998). Distinct functions of the closely related tandem RNA-recognition motifs of hnRNP A1. RNA. 4, 1111-1123.
11. Mayeda, A., Screaton, G.R., Chandler, S.D., Fu, X.D. & Krainer, A.R. (1999). Substrate specificities of SR proteins in constitutive splicing are determined by their RNA recognition motifs and composite pre-mRNA exonic elements. Mol Cell Biol. 19, 1853-1863.
12. Mayeda, A., Zahler, A.M., Krainer, A.R. & Roth, M.B. (1992). Two members of a conserved family of nuclear phosphoproteins are involved in pre-mRNA splicing. Proc Natl Acad Sci USA. 89, 1301-1304.
13. Eperon, I.C., Ireland, D.C., Smith, R.A., Mayeda, A. & Krainer, A.R. (1993). Pathways for selection of 5' splice sites by U1 snRNPs and SF2/ASF. EMBO J. 12, 3607-3617.
14. Sun, Q., Mayeda, A., Hampson, R.K., Krainer, A.R. & Rottman, F.M. (1993). General splicing factor SF2/ASF promotes alternative splicing by binding to an exonic splicing enhancer. Genes Dev. 7, 2598-2608.
15. Huang, M., Rech, J.E., Northington, S.J., Flicker, P.F., Mayeda, A., Krainer, A.R. & LeStourgeon, W.M. (1994). The C-protein tetramer binds 230 to 240 nucleotides of pre-mRNA and nucleates the assembly of 40S heterogeneous nuclear ribonucleoprotein particles. Mol Cell Biol. 14, 518-533.
16. O'Keefe, R.T., Mayeda, A., Sadowski, C.L., Krainer, A.R. & Spector, D.L. (1994). Disruption of pre-mRNA splicing in vivo results in reorganization of splicing factors. J Cell Biol. 124, 249-260.
17. Chandler, S.D., Mayeda, A., Yeakley, J.M., Krainer, A.R. & Fu, X.D. (1997). RNA splicing specificity determined by the coordinated action of RNA recognition motifs in SR proteins. Proc Natl Acad Sci USA. 94, 3596-3601.
18. Xu, R.M., Jokhan, L., Cheng, X., Mayeda, A. & Krainer, A.R. (1997). Crystal structure of human UP1, the domain of hnRNP A1 that contains two RNA-recognition motifs. Structure. 5, 559-570.
19. Huang, S., Mayeda, A., Krainer, A.R. & Spector, D.L. (1997). RCC1 and nuclear organization. Mol Biol Cell. 8, 1143-1157.
20. Caputi, M., Mayeda, A., Krainer, A.R. & Zahler, A.M. (1999). hnRNP A/B proteins are required for inhibition of HIV-1 pre-mRNA splicing. EMBO J. 18, 4060-4067.



