程 久美子 Kumiko Ui-Tei
1) 東京科学大学・総合研究院・特任教授
2) 東京大学・大学院理学系研究科・生物科学専攻・特任研究員
米マサチューセッツ大学のVictor Ambros博士と米ハーバード大学のGary Ruvkun博士は、線虫のmiRNA発見についての論文を1993年に発表し(1, 2)、それから約30年後の2024年にノーベル生理学・医学賞を受賞した。miRNAは21-25塩基程度の一本鎖のノンコーディングRNAであり、部分的に相補的な塩基配列をもつmRNAにアンチセンス鎖として対合し、その翻訳を制御する(図1)。しかしながら、このような小さなRNAによる遺伝子発現の制御は、限定的な原理として捉えられ、miRNAに関する次の論文が発表されたのは、7年後の2000年であった(3)。それ以降は、生命科学におけるmiRNAの重要性は明確で、miRNAによる遺伝子制御はヒトを含む多細胞生物にとっても不可欠のメカニズムであることが明確となり、ヒトではすでに2,000種以上ものmiRNAが同定されている。
直近のRNAを用いた創薬としては、COVID-19のパンデミックにより、mRNAワクチンの利用が爆発的に拡大した。mRNAワクチンは投与されたmRNAからタンパク質が産生され、抗体の生成を誘発して働くので、作用機序としては遺伝子発現を抑制するmiRNAとは異なるものである。しかし、mRNAワクチンの普及により、一般的に“RNA”の有用性が広く認知され、身近なものと捉えられるきっかけとなり、2023年にはmRNAワクチンの開発に大きく貢献した米ペンシルベニア大学のKariko Katalin博士とDrew Weissmann博士がノーベル生理学・医学賞を受賞した。さらに、一般の認知度はまだ低いが、miRNA と同様に、mRNAを標的として、その発現を抑制するという類似の作用機序を示すアンチセンスオリゴヌクレオチド(ASO)やsmall interfering RNA (siRNA)を用いた医薬品は核酸医薬品と呼ばれ、その開発は加速的に進んでいる。それに対して、miRNAの医薬品としての開発は少なからず遅れを取っているが、その理由は明確である。すなわち、後述するように、哺乳類細胞において、miRNAは理解が難しい複雑なメカニズムによって機能するため、そのメカニズムが理解されない状況下では、薬剤の開発を実装することが難しいからと言えるだろう。しかし、昨今、miRNAのメカニズムの理解は着実に進み、miRNAによる緻密な遺伝子制御の作用機序が明らかになりつつあり、miRNAの標的を探索する、より良いツールも利用可能になってきている。このような進展により、「医薬品開発のターゲットとなりうるmiRNAを選択する」ことが可能となってきている。
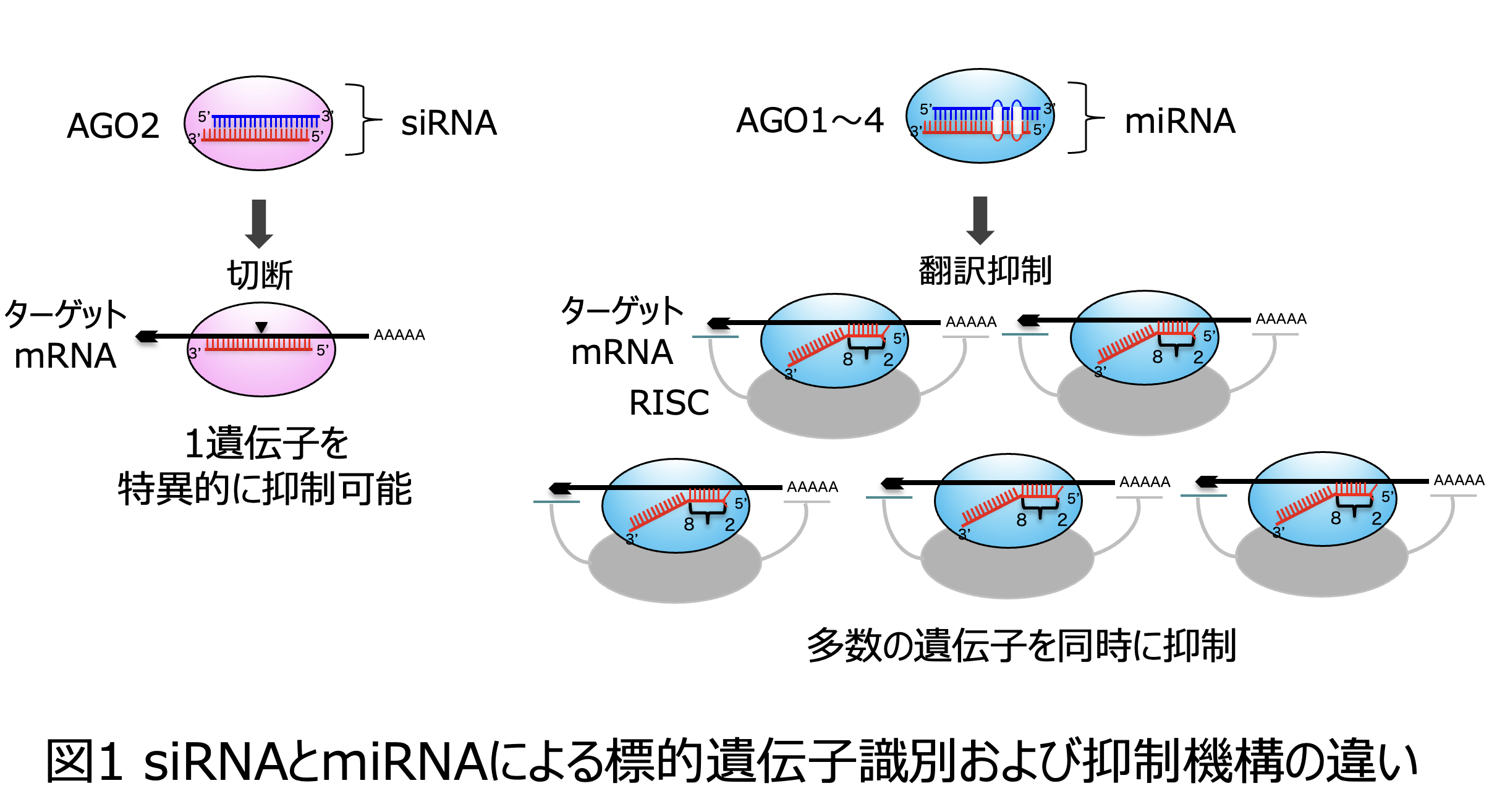
siRNAは二本鎖RNAであり、miRNAとよく似た機構で働く(図1)。miRNAの発見から5年後の1998年に、米カーネギー研究所のAndrew Fire博士と米マサチューセッツ大学のCraig Mello博士は長い2本鎖RNAがRNA干渉(RNAi)によって線虫の遺伝子の翻訳を制御できることを報告し(4)、2006年にはノーベル生理学・医学賞を受賞した。2001年には、独マックスプランク研究所のSayda Elbashir博士とThomas Tuschl博士が長い2本鎖RNAからダイシングされた短いsiRNAは哺乳類細胞でも効率的なサイレンシング(遺伝子抑制)を誘導することを発見し、哺乳類RNAi研究とその応用技術開発に大きな波を引き起こした(5)。そして、たった数か月のうちにsiRNAは実験ツールとして広く普及しただけでなく、2年以内には、siRNAを用いた臨床応用をめざした複数の企業が設立された。しかしながら、創薬における臨床開発ではよくあるように、何年もの間、浮き沈みを繰り返しながらゆっくり開発が進められ、RNAiの発見からちょうど20年目にあたる2018年に最初のsiRNAが医薬品として認可されるに至った。その後は、アンメットメディカルニーズに対応可能な、標的とする疾患原因遺伝子のみを抑制できる特異性の高い新規の医薬品として、およそ1年に1品目という非常に早いスピードで開発が進み、2024年末の時点では6品目のsiRNA医薬品が承認されている (6, 7)。これまでのsiRNAはすべて肝臓で機能する遺伝子を標的としているが、研究レベルでは、その標的が眼や中枢神経系、筋肉、その他の臓器へと拡大している。
siRNAとは対照的に、miRNAを用いた臨床プログラムは、あまり成功を収めていない(8, 9)。siRNAもmiRNAも21〜25塩基程度の小さなRNAで、2本鎖状態から1本鎖RNAとなって、標的とするmRNAに塩基配列相補的に対合して働く(図1)。いずれも、Argonaute(AGO)タンパクに取り込まれ、相補的な配列をもつmRNAに対合して働くという点は非常によく似ている。しかし、その標的認識および抑制機構は大きく異なっている(図1)。siRNAはほぼ全長で標的mRNAを区別して対合し、切断する一方で、miRNAは主にガイド鎖の5'末端から2–8番目の7塩基長のシードと呼ばれる領域を利用して標的mRNAの3'非翻訳領域(3'-UTR)と対合し、基本的にはAGOに加えてRNA-induced silencing complex (RISC)という複合体に含まれるタンパク質を介してmRNAの翻訳を抑制する。21〜25塩基と7塩基の違いは確率的に標的識別能に大きな違いをもたらす。siRNAはすべてのmRNAの中から1遺伝子由来のmRNAを区別することが可能であるが、miRNAは確率的にも1種のmRNAのみを区別して抑制することは難しい。このようにmiRNAは複数の標的に同時に作用するという、相対的に特異性の低い、極めて複雑なメカニズムで働くところが miRNAの医薬品としての開発を難しくしている最も大きな理由と言えるだろう。miRNAの標的遺伝子を正確に同定するために、多くの研究室では、病気に関連する遺伝子の3'-UTRにmiRNAの標的配列があるかどうかを計算的に予測し、その遺伝子の発現を制御するシステムを明らかにしようとする研究を行ってきた。しかし、多くの論文が発表されたにも関わらず、その複雑さから、現状では病気のメカニズムに関する実践的な洞察にはつながっていない(10)。
上述したようなmiRNAとsiRNAの作用機序の違いから、miRNA医薬品開発はsiRNAとは異なる戦略が取られている。近年、免疫疾患やアルツハイマー病、心疾患、がんなどの様々な疾患とmiRNAの発現量の間に相関関係があることが明らかになってきた。しかし、現状では、miRNAの場合には標的とする遺伝子を正確に特定することは難しいため、miRNAが関与する疾病に対する医薬品開発の基本方針は、①疾病の原因となるmiRNAの機能を阻害する「阻害療法」、あるいは②疾病において発現量が減少したmiRNAを補う「補充療法」の2種類に大別される(表1)。
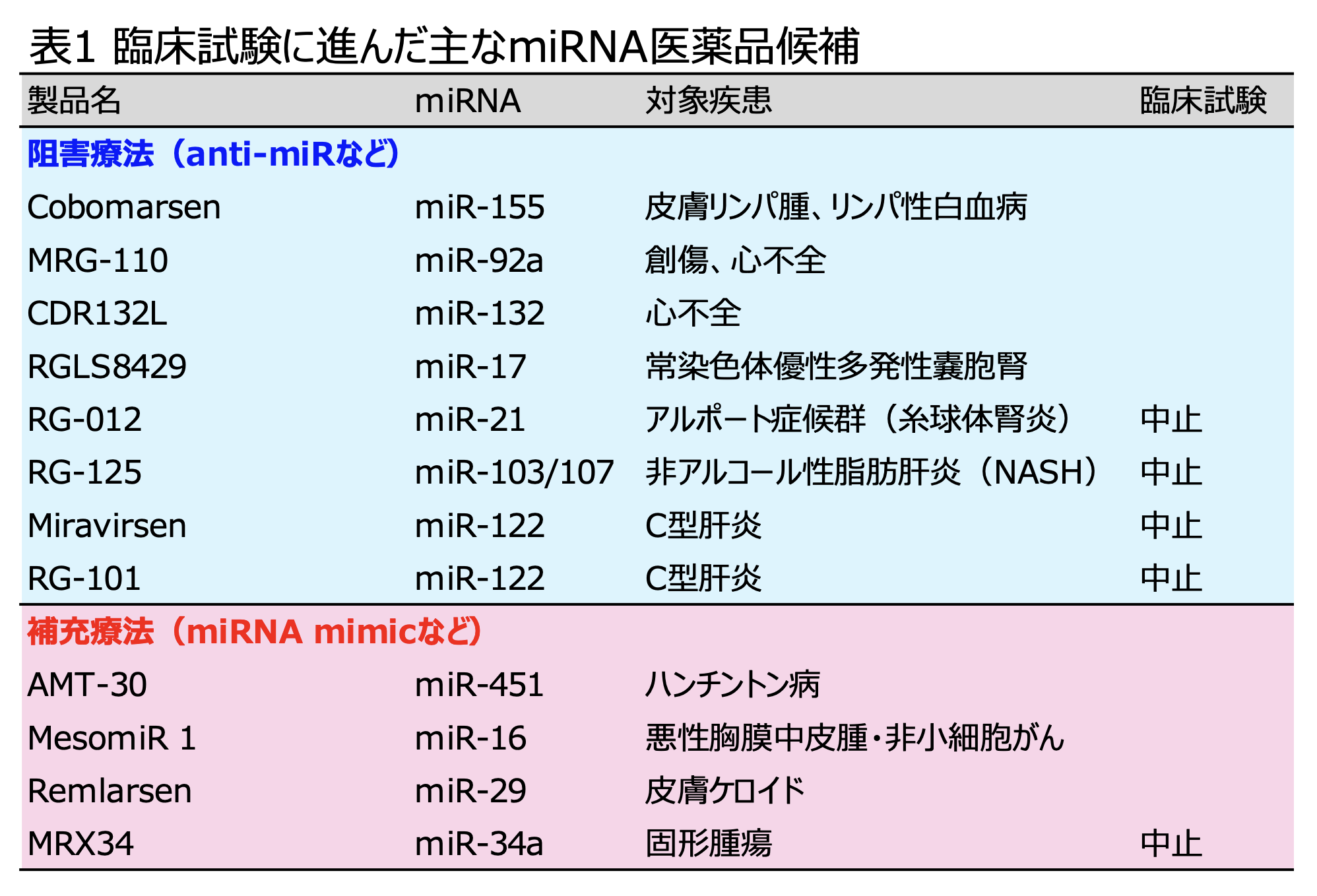
「阻害療法」としては、anti-miR (AntagomiR)が利用されているが、これは生体内に存在するmiRNAと相補的な配列をもつASOをanti-miRとして用いて、miRNAと直接対合させることにより、内在のmiRNAとmRNA間の塩基対合を競合的に阻害する。たとえば、がんの原因となるmiRNA(oncomiR)の1つであるmiR-155は腫瘍組織において高発現しており、miR-155の過剰発現はリンパ腫や白血病を誘発する。そのため、miR-155を阻害するanti-miR(Cobomarsen)が開発された。これは臨床試験でも良好な結果が得られ、第2相試験が進行中である。また、心筋肥大を調節するmiR-132に対するanti-miRであるCDR132Lの投与により心機能の改善が見られており、第2相試験が進行中である。しかし一方では断念された試験もある。miR-122 は肝臓に大量に発現しており、C型肝炎ウイルス(HCV)の複製に関与している。そのため、MiravirsenやRG-102などのmiR-122のanti-miRが開発され、第2相臨床治験でも良好な結果が得られた。しかし、肝臓の脂質代謝や肝機能の維持にも影響を与えるという副作用があることが明らかとなり、さらには直接作用型抗ウイルス薬という治癒率の高い薬剤の出現などにより、開発が中止された。また、miR-21に対するanti-miRであるRG−012は、アルポート症候群という遺伝性腎疾患を対象とした薬剤として第2相臨床試験で評価された。安全性には問題はなかったものの、効果が不十分で試験は中止された。現在では、ASO とは異なるanti-miR として、発現ベクターベースのシステムとしてmiRNAスポンジやTough Decoy RNA(TuD RNA)も開発されており、miRNAと相補的な配列を2箇所以上もつmiRNA阻害剤として効率よく働くものも開発されつつある。
「補充療法」は、疾病の発症や進行に伴い、特定のmiRNAの発現量が減少した細胞や組織に対して、人工合成したmiRNA(miRNA mimic)を補充する治療法である。miR-34aは腫瘍抑制miRNAとして知られており、がん細胞の増殖抑制やアポトーシス(細胞死)の誘導に関わる。そのため、miR-34aを補充する「MRX34」が開発され、がん治療薬として期待された。しかし、サイトカインストーム(過剰な免疫反応)による深刻な影響を与えたため、開発が中止されている。一方、近年、miRNAの構造とsiRNA様の配列をもつartificial miRNA(amiRNA)も開発されている。amiRNAは内在のmiRNAと異なり、siRNAと同様に全長で標的mRNAを認識するように設計されているため高い標的特異性を示す。2021年、ハンチントン病の原因遺伝子であるhuntingtin(HTT)に対するamiRNA医薬品としてAMT-130が開発された。AMT-130はアデノ随伴ウイルスベクターAAV5を用いたpri-miR-451の発現システムを用いており、脳に直接送達され、pre-mir-451が転写され、細胞内でプロセシングをうけた成熟型miR-451がHTT遺伝子を抑制する。これまでにハンチントン病に対する抗miRNAオリゴヌクレオチド医薬品は上市されていないことから、ハンチントン病に対する新たな医薬品として期待されている。
現状では、未だ承認まで至ったmiRNA医薬品は存在しない。miRNA医薬品の初期の臨床プログラムでの失敗例が示すように、その開発は容易ではない。多くの中止に至った事例は、臨床試験で示された効果より副作用が上回り、成功に至らなかったと言える。しかし、現状では、途中で中止されているものは多いものの、miRNAがヒトの病気に関わる遺伝子を標的とし得ること、そして薬剤候補として良好なmiRNAが特定できうることも示しており、現在開発中および臨床治験が進行中のmiRNA医薬品候補に期待したい。どのような医薬品でも、開発者は商業的に競争力があり、患者に利益をもたらす可能性が最も高いものを特定する選択肢を持つ一方で、あらゆる薬剤開発と同様に、miRNA 創薬開発の成功にはmiRNAの複雑な作用機序の正確な理解に基づく、より慎重なmiRNAの選択が必須といえるだろう。
参考文献
- Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75(5):843-854.
- Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 1993;75(5):855-862.
- Pasquinelli AE, Reinhart BJ, Slack F, Martindale MQ, Kurodak MI, Maller B, Hayward DC, Ball EE, Degnan B, Müller P, Spring J, Srinvasan A, Fishman M, Finnerty J, Corbo J, Levine M, Leahy P, Davidson E, Ruvkun G. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature. 2000;408(6808):86-89.
- Fire A, S Xu, MK Montgomery, SA Kostas, SE Driverand CC Mello. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811.
- Elbashir SM, W Lendeckel and T Tuschl. RNA interference is mediated by 21- 22-nucleotide RNAs. Genes Dev. 2001;15:188-200.
- Egli M and M Manoharan. Chemistry, structure and function of approved oligonucleotide therapeutics. Nucl Acids Res. 2023;51:2529-2573.
- Hofman CR and DR Corey. Targeting RNA with synthetic oligonucleotides: Clinical success invites new challenges. Cell Chem Biol. 2024;31:125-138.
- Zhang S, Z Cheng, Y Wang and T Han. The Risks of miRNA Therapeutics: In a Drug Target Perspective. Drug Des Devel Ther. 2021;15:721-733.
- Winkle M, SM El-Daly, M Fabbri and GA Calin. Noncoding RNA therapeutics -challenges and potential solutions. Nat Rev Drug Discov. 2021;20:629-651.
- Kilikevicius A, G Meister and DR and Corey. Reexaming assumptions about miRNA-guided gene silencing. Nucl Acids Res. 2022;50:617-634.



