はじめに
最近特に話題になっているmRNAワクチン。このmRNAにはキャップ構造がついていて、それが細胞内での翻訳には必須である。翻訳におけるキャップ構造の重要性は言うまでもない。古市先生による会報での素晴らしい連載により、日本RNA学会の会員の方々には、キャップ構造がどのようにして発見され、いかに重要かが伝わっていることと思う。今キャップ構造が再び注目されているこの時を、キャップ構造について大学院時代に研究をしてきた自分にとっては、大変嬉しく思う。その反面、キャップ構造は核内でも重要だということをみなさんはご存知だろうか、eIF4E以外に、NCBP1、2と現在データベース上で言われているキャップ結合タンパク質の存在をご存知だろうか、と思う時がある。会報を編集されている富山大学の甲斐田さんにお話ししたところ、許可をいただいたので、私が大学院時代に経験した、核内キャップ構造結合タンパク質精製への道のりを書かせていただくことにした。多くの会員の方は、核内キャップ構造結合タンパク質を精製、報告した二つの研究室のうち一つは日本の研究室だということをご存知ないかもしれない。そのことを知っていただくとともに、私がここから得た教訓を、特に若い会員の皆さんにお伝えできれば、と思う。
私の好きな小説の1つに推理小説がある。特にアーサー・コナン・ドイル卿によるシャーロックホームズの冒険は最も好きな小説の1つだ。昔エジンバラでRNA Societyの年会があったとき、一人で歩いているとドイル卿の碑に思いがけず出くわし、思わず喜んで写真を撮った記憶がある (ドイル卿はエジンバラ出身である)。有名なホームズのセリフの1つに次のものがある。「あらゆる可能性を検証し、全ての不可能な可能性を除外して最後に残ったものが、如何に奇妙なことであってもそれが真実となる。」これはまさに科学に従事するものとしては心に留めておくべきものではないだろうか。私は後にこのことを痛感させられることになる。また、小説中には出てこないが、映画やテレビの中で、「初歩的なことだよ。ワトソン君 (Elementary, my dear Watson.)」とホームズが得意げに話す有名な台詞がある。ホームズにとっては、今回書く内容も、初歩的なものかもしれない。ちなみに私が一番好きな実写版のホームズは、グラナダTV版でジェレミー・ブレット氏が演じたホームズである。
1987年、私は京都大学理学部の4年生であった。当時は4年生になって研究室に所属するのは、大学院合格発表の後、9月くらいという決まりがあった。私は理学部生物物理学教室の形質発現学講座、志村令郎先生の研究室に所属することになっていた。当時の志村研究室には、助手として坂本博さん(現神戸大学教授)、大学院生として大野睦人さん (前京都大学教授)、澤斉さん (現遺伝研教授)、井上邦夫さん (現神戸大学教授)らがいらっしゃり、4年生が(今でも?)到底太刀打ちできない方々が揃っていて、基礎から本当によく鍛えていただいた。その当時、古市先生が志村先生を訪ねて来られたことがあり、筆者がご案内したのも記憶している。
志村研では、キャップ構造のmRNAスプライシングにおける役割を研究しており、大野さんを中心として、キャップ構造がそれにもっとも近いイントロンのスプライシングを促進することを見出していた(文献1)(この論文での実験は試験管内スプライシング反応を用いたもので、その反応系については、藤田医科大学の前田明さんの連載(第1回、第2回、第3回)に詳しく書かれている)。つまり、3つのエクソンと2つのイントロンを持つmRNA前駆体でスプライシングが起きる場合、キャップ構造が存在するmRNA前駆体では、第一イントロンのスプライシングが効率よく起きる。キャップ構造がないmRNA前駆体の場合、第一イントロンのスプライシングがほとんど起こらない。第二イントロンのスプライシングはキャップ構造の有無に影響を受けない。つまりキャップ構造によるスプライシング促進効果は、第一イントロンのみに及ぶことが明らかになった (図1、文献1)。
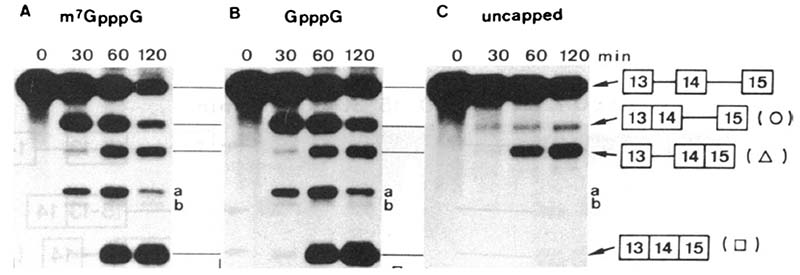
図1 キャップ構造による第一イントロンのスプライシング促進効果。図中○が、第一イントロンが除去されたmRNA前駆体である。uncapped (C) では、m7GpppG (A)、GpppG (B) capのmRNA前駆体よりも○の産生が低く、結果的に最終産物(□)の産生も低い。GpppG capは、HeLa細胞核抽出液内で速やかにm7G化されるため、m7GpppGと同様の結果となる。文献1より改変。
この論文では、m7GpppGをcompetitorとして反応に用い、m7GpppGを加えると、キャップ構造による第一イントロンのスプライシング促進効果がなくなることを見出している。このことは、HeLa細胞核抽出液中には、キャップ構造に結合し、キャップ構造によるスプライシング促進効果を担う因子が存在していることを強く示唆している。この論文は筆者が研究室に入る時にはすでに出版されていた。
よりin vivoに近い条件でも研究が行われ、アフリカツメガエルの卵母細胞への微量注入実験によってキャップ構造による促進効果があるかどうかが検定された (文献2)。こちらは井上さんが主導された論文であるが、微量注入実験をされている時は、特に注意をされたわけではなかったが、実験台を揺らさないように気をつけていた思い出がある。この実験では、in vitroの実験とは異なり、uncappedのpre-mRNAが速やかに分解されてしまい、negative controlとはなり得なかった。そこで、m7GpppGの代わりに、ApppGをpriming nucleotideとして使うというアイデアが使われた。in vitroでのRNA転写系には、T7やSP6などのファージRNA polymeraseが使われるが、反応系にGTPの10倍の濃度でm7GpppGを入れておくと、転写開始点がGの場合、GTPの代わりにm7GpppGを最初の塩基として取り込んで合成を始めてくれる。この系にApppGを用いると、ApppGから始まるmRNA前駆体が出来上がる。uncappedとは異なり、5’端は通常のキャップ構造と同じく5’-5’のブロッキング構造を持っているため、同程度の安定性が見込める。これはすごいアイデアだと感心したことをよく覚えている。現在もA capは通常のキャップ構造のnegative controlとして、安定性への関与とは切り離して考えられる系として広く使われている。
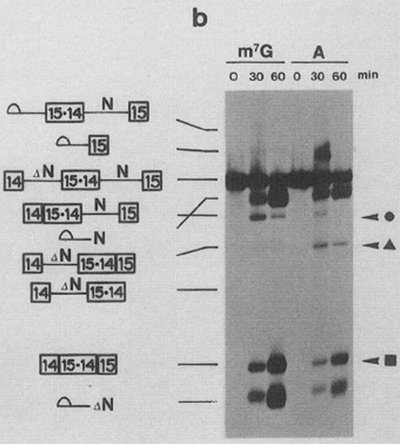
図2 アフリカツメガエル卵母細胞におけるキャップ構造の効果。図中●で示した産物が、第一イントロンが除去されたmRNA前駆体で、■が最終産物である。文献2より改変。
in vitro反応系ではm7GpppGがcompetitorとして働いたが、アフリカツメガエル卵母細胞内ではうまく働かなかった。そこでcompetitorとして使われたのが、pSP64というプラスミドをMCS内にあるEcoRIで切断してlinearにしたものを鋳型として合成した57塩基長(MCS配列)のRNAが使われ、competitorとしてよく働くことがわかった (文献2)。
in vivoでも核内キャップ構造結合タンパク質の存在が強く示唆されたため、いよいよ核内キャップ構造結合タンパク質の同定と精製へと進むことになった。最初の段階として、どのようにしてそのタンパク質の存在を同定する系を作るか、ということがあった。ここから筆者は4年生として大野さんの指導の下、お手伝いに入るのである。通常は分子生物学的手技 (遺伝子クローニング) を最初に学ぶのであるが、いきなりRNAを作ってRNAのゲルシフト法の条件を決めるということが最初の仕事となった。m7G capまたはA capをつけたpSP64由来RNA (α-32P GTPで標識してある) をprobeとして、HeLa細胞核抽出液と混合して非変性ポリアクリルアミドゲル電気泳動により、probeのシフトを観察する実験である。HeLa細胞核抽出液はタンパク質濃度が10-20 mg/mlと非常に濃く、そのまま用いたのではRNAもaggregateしてしまい、うまくゲルに入らない。そこで希釈することになるのだが、薄め過ぎてもm7G capに特異的なバンドは見られなくなってしまう。そこで色々な希釈率とnon-specific bindingを抑えるためのyeast tRNAの量、塩濃度の違い、detergentの有無等に関して様々なアドバイスをいただいて試行錯誤の結果、freeのRNA probeが検出でき、さらにm7G cap特異的なバンドを検出できる条件を見つけることができた。当時はゲル電気泳動後にゲルをろ紙に貼り付けて乾燥し、ろ紙と一体化したゲルをX線フィルムに露光して結果を得る。大野さんがそのフィルムを大学院生と志村先生とのお昼のミーティングで示して話をしてくれたらしい。そんなミーティングがあるとは全然知らなかったので、ミーティング後に澤さんからいい結果出たなとほめられたのにキョトンとしたのを覚えている。そのフィルムはもう手元にはないが、今であればscanして残しておいたのに、とも思う。
これで系が整ったので、次は精製へと進む条件決めへと進むことになった。当時はMS解析などなく、タンパク質を分解してペプチドにし、そのペプチドの配列を決定していく、という方法であったため、μgの単位でタンパク質が必要であった。
(続く)
引用文献
1. Ohno, M, Sakamoto, H. and Shimura, Y. (1987)
Preferential excision of the 5' proximal intron from mRNA precursors with two introns as mediated by the cap structure
Proc. Natl. Acad. Sci. USA. Vol. 84, pp. 5187-5191
2. Inoue, K., Ohno, M., Sakamoto, H. and Shimura, Y. (1989)
Effect of the cap structure on pre-mRNA splicing in Xenopus oocyte nuclei
Genes & Dev. 3:1472-1479



