新型コロナウイルスが世界中に多大の被害を与えている。中国発のウイルスが、あっという間に広がり、すでに世界で330万人が感染し、死者が25万人も出ている。もっとも被害が大きいのは米国で、そこでは感染者が110万人、死者が6万5千人を超えるという。幸いなことに、この時点、日本では感染者は1万5千人、死者は約500人と少ないが、油断すると米国の二の舞になりかねない。ここは、日本の底力でしのぎたいものである。
100年前、インフルエンザウイルスによるスペイン風邪 (1918~1919年) の時は、もっとひどかった。世界で6億人が感染し、2300万人が死亡、日本では人口の半分の2400万人が感染し、39万人が亡くなるという大惨事だったのである。しかし、いまや、我々には100年前にはなかった知識や医薬品や、進んだ報道媒体が津々浦々へ、情報や指示を伝えることができる。それらを駆使して、何としても、100年前の悲劇を繰り返してはならない。ウイルス感染といえば、人類は永く天然痘などDNAウイルスの蔓延に苦しめられてきたが、ワクチン療法の発見により、感染を抑えることができ、1980年には、ついに、撲滅宣言ができた。
しかし、RNAウイルスは一筋縄ではゆかない。RNAウイルスは種類が多いうえに、遺伝子組み換え (Recombination) を重ね、ワクチンや自然免疫をかいくぐって、―――コロナウイルスを例にとってみてもーーーSARSやMERSが忘れられた頃に出現し、今回のSARS-CoV-2のような凶暴な新ウイルスに化けて、大暴れするなど、誠に厄介である。コロナは、インフルやポリオと比べると、歴史的にみて人類とのコンタクトが短いウイルスであり、老生がJournal of Virology誌のAssociate Editorを務めていた5年間 (1980~1985年) に論文を査読したことは一度もなかった。名前を聞いたのはその10年後くらいであり、被害も研究も、“経験の浅い” ウイルスだったといえる。このところ、テレビでは、コロナに関する話題で持ちきりであるが、この稿は、RNA研究者の読者諸賢へ向けて、ウイルスのRNA学的な面や、病理や、ウイルスの特徴を標的とした創薬に触れながら進めたい。
最近、SARS-CoV-2による死因が、単に呼吸器系の肺炎によるものだけではないことがわかってきた。ウイルスの受容体が、血管系に広く分布するACE2 (Angiotensin-converting enzyme 2) という血圧の調節に関係する細胞表面タンパクであることがわかり、そのことから、ウイルスがそれらの細胞で繁殖し、そのため、死因が肺炎による呼吸の不全だけにとどまらず、ウイルス感染が血栓などの原因となり、心臓、腎臓、消化器、神経や脳の機能を止め、突然死の原因を作ることがわかってきた。したがって、身体のどこかに、何らかの問題を抱えて生きてきた、高年齢者には、恐ろしいウイルスであることが判りつつある。では、どうすればよいのか?老生は、コロナの増殖に関して、分子生物学的なハッキリしたメカニズムを理解し、「ウイルス増殖の勢いを削ぐ処方を考え、ウイルスと戦う強い抗体が体内に生まれるまでの時間を稼ぐこと」―――だと思っている。孫氏の兵法に言うーーー「彼を知り己を知れば百戦して殆うからず」―――というところであろうか。
コロナウイルスの不思議
コロナウイルスは、一本鎖のプラス鎖RNAをゲノムとして持つウイルスであり、ウイルス粒子の中にメッセンジャーRNA (mRNA) と同じプラス鎖の―――3万塩基ほどの長いーーーRNAが一本、Nタンパク質にくるまれて、螺旋を巻いて入っているだけの、シンプルなウイルスである。ウイルス粒子自身はなんらの酵素活性を持たないが、そのRNAの5'末端にはキャップ構造があり、3'末端にはポリAが付いていて (図1)、RNAが細胞質へ入りさえすれば、それを鋳型にして増殖に必要な酵素を全てつくる。このエッセイの4話と12話で描写したインフルのように核へ行くことはない。また、mRNAにキャップがなければ、タンパク合成に使われないし、RNAは不安定で5'ヌクレアーゼにより壊されてしまうことは、第21話の「45年前の野球帽」ですでに紹介したが、コロナウイルスのRNAはしっかりキャップを持っているのである。

図1.これまでに現れたコロナウイルのゲノムRNA構造132
コロナのゲノムは、だから、長いmRNAそのものであり、実験的にはゲノムRNA自身が感染性である。完全長のcDNAを細胞内へ入れると、感染性のウイルスが出現する。この辺のところは、ポリオなどピコルナウイルスと似ている。故野本明男さんが1980年代に、ポリオで種々の変異株を創生して、ウイルスの毒性や脳へ移行するメカニズムなど先駆的な研究を進めていたが、1990年代に入ってからは、世界では、同様の分子ウイルス学的研究がコロナについても行われた。ポリオも、コロナもーーープラス鎖の長いRNA遺伝子を持つウイルスであることがよく似ている。ポリオの場合、ソーク不活化ワクチンや、セービン生ワクチンなど防御策がある中での、野本さんの研究であったが、コロナの場合、もし、そのようなワクチンによる防御システム無しに組み替え実験が、安易に行われていたとすれば犯罪としか言いようがない。コロナは、cDNAを介した組み換えを介さなくても、ウイルスRNA間で自然に組み換えがおこり、新種ウイルスが生まれるという厄介な難敵である。例えば、ヒトのコロナと他動物のコロナが同じ細胞に共感染するとハイブリッドウイルスが生じる。先のSARSや、今回のCOVID-19がコウモリコロナとのハイブリッド変異株 (――と中国は主張している) であったり、MERSが一瘤ラクダ由来であるとか、家畜や猫などペットからも人にも感染するウイルスが自然発生するから、今後も、新ウイルスが出現してくることが予想されるので「まったく気が許せない」のである。それらの新生ハイブリッドウイルスは、細胞の中では、当初は稀少であり、大抵は親ウイルスとの競争によりウイルス集団の中で淘汰されてしまう。しかし、人工的に組み換え体を作るとなると、―――これは、話がまったく別でありーーー最初から大きな新ウイルス集団を作ることになるのでーーあらかじめ届け出てーー漏洩などがないように厳重に管理されなくてはならない。
結果論であるが、世界の経済的損失が数千兆円にもなるのであれば、「ワクチンを作ればよいのだ」などと安易に切り捨ててないで、―――RNAウイルスの研究をーーー複製メカニズムの解明や、その成果を応用した治療薬の作成などーーー地味に思われる研究であってもーーー、研究費と関心を注ぐべきだったのである。ウイルスは、粒子の表面抗原 (コロナの場合はスパイク蛋白) が変異すればワクチンは効かなくなるが、ウイルスの複製などにかかわるーーーウイルスにとってエンジン部分なので、容易には変異できない酵素はーーー他のウイルスとは違うので、特効薬として開発の際の良い標的となるのである。例を挙げれば、インフルの増殖を抑える薬として開発されたタミフルは、20年前に発明された古い治療薬だが、いまだに出現してくる新手のインフルエンザウイルスに対して治療薬として大活躍している。一方、ワクチンの場合は、毎年、あるいはその都度、新種ウイルスに備えなければならないであろう。がん研究もiPS細胞も大切だが、人類は、まだ見ぬウイルス感染症の研究に努力を傾注しておかねばならなかったのだと反省している。特に、日本は、ウイルス学の研究者の活躍が少ないことが反省される。このエッセイを書くにあたり、ウイルス関係の論文を数報読んでみたが、参考文献欄にサイトされている約1000報のうち、日本人がファーストオーサーになっている論文があまりに少ないので驚いてしまった。数えてみたら、わずかに3報しか無かったのである。そのうち一報は、なんと、筆者のまだ若い折のキャップに関する論文であった。そんなことで、老生は、この機にRNA研究者のウイルス学へのチャレンジを切に望むところであり、今後に期待している。手近には、本稿からヒントを得て、コロナ攻略のための創薬に参考にしていただければ幸いである。さあ、―――それではーーーコロナウイルスの実像へ入ろう。
コロナウイルスの実像
コロナウイルスは、マウスを含む齧歯類、犬、ねこ、鳥、豚など、ほぼすべての動物からから発見されるが、それぞれが動物種に特異的であり、他のウイルスほど厳密でないとしても、動物種を超えて感染することはまれである133。1990年代、他動物のコロナウイルスについて研究が始まったが、それらの遺伝子はどれも良く似ていた。遺伝子の5'上流には、複製や転写にかかわるーーーエンジン部分に相当するタンパクがあり、それらは、ウイルス粒子に含まれないnsp (non-structual protein) の遺伝子が並び、その下流にはウイルス粒子中にあらわれるsp (structural protein: 構造タンパク) の遺伝子が続いている。図2に示すように遺伝子を包む外膜は、感染細胞から飛び出る時に被った脂質二重膜で、粒子のサイズはおおよそ直径が100 nmほどの中型ウイルスである。その膜を突き抜けて飛び出しているスパイクタンパクを介して、感受性細胞の表面にある糖タンパク受容体を介して細胞内へ侵入する。今回のSARS-CoV-2ウイルスが細胞侵入に際して結合する受容体は、血圧の調節に働くAngiotensin-converting enzyme 2 (ACE2) である。ACE2が、血管や気管支や肺臓に広く分布していることがコロナの病理を複雑にしている。
さて、受容体を介して細胞内に入ったウイルス粒子は分解されて、RNAゲノムは裸になって細胞質へ飛び出し、螺旋は解消されるーーーこの辺りは、タバコの葉に感染し、タバコ事業へ被害を与えた、タバコモザイク植物ウイルスとよく似ている。

図2.コロナウイルス粒子とmRNA転写マップ(最新のKim et al.134 から)
細胞質では、5'末端にはキャップが付いているから、すぐにリボソームと結合して、タンパク合成が始まる。タンパク合成はキャップ依存型の翻訳で進み、二つの大きなタンパクORF1aとORF1bが最初にできる (図2)。この二つは、コロナの増殖を支えるうえで、最も重要な初期の役割を演じるタンパクであり、ウイルスのエンジン部分である。
例えば、
- mRNA合成のための鋳型となるマイナス鎖RNAを作るポリメラーゼである
- 新生ウイルスのためのプラス鎖ゲノムRNAを作るポリメラーゼでもある
- 10種類ほどのnsタンパクを作るための短いmRNAをつくる
- キャップm7GpppAmを作るためのGTase活性を持つ (――と思われる)
- 宿主細胞のmRNA合成を止める (Shut-off) する活性を持つと思われる
などである。
リボソームを終止コドンで一歩ステップバックさせる面妖な動き
長いゲノムRNAから作られる最初のタンパクはORF1aである。しかし、そのあとで作られるORF1bタンパクは、ORF1aの合成が終止コドンへ来たところで、リボソームはそこで止まらないで、5'側へ1塩基分ステップバックして、読み枠フレームをずらして、さらに8千塩基ほども翻訳を進めて、ORF1aを含む大きなポリプロテインとなる。この不思議な現象をRibosomal frameshiftingという。今から20年ほど前に、老生らが細胞のmRNAキャッピングについてレビューを書いたとき、すでにこの面妖な現象は知られていて、―――コロナは変なウイルスだーーーという印象を持った。その折、台湾出身で南カリフォルニア大学 (USC) の教授だったLai博士が膨大な量の研究をまとめた論文を書いていて、参考にさせてもらった135。彼は、終止コドンの周辺には、「リボソームが滑りやすい配列UUUAAAC」があり、その近くに「RNA2次構造」が関係しているとしたが、本当のところは、現在も、まだ解明されてないようである。私には、RNAの2次構造に加えて、最初に作られるORF1aが関与しているように思えてならない。他方、この反応は、癌細胞を除き、コロナに特異的であるようであるから、抗コロナウイルス創薬の良いターゲットになるかもしれない。
筆者の最も興味のあるところは、コロナのmRNA合成中、どのようにしてキャップが作られるかであるが、そのためのキャッピング酵素 (GTase) の所在が、いまだわかってなくて残念である―――もし見つかれば、GTaseはよい創薬候補になると思われる。その一方、GpppAp-をメチル化してm7GpppAmをつくる酵素のm7G-MTase や2’-O-MTaseは、それぞれnsp14 とnsp16タンパクであると同定されている。2’-O-MTaseはともかく、m7G-MTaseは創薬ターゲットとなろう。
さて、ウイルス粒子から突き出ているスパイクタンパクは,ワクチンを作る際の最も重要な標的であり、S領域からつくられるが、ここは最も頻繁に変異が起こる領域でもある。従って、ウイルスが、今回のパンデミックのように、多くの人を経由して増殖している間に、スパイク遺伝子が組み換えを起こしたり、変異を取り込んだりしてーーー最初に発見されたウイルスをもとにデザインされたワクチンがーーー効力を発揮できないリスクもあることを覚悟しておかねばならない。実際、武漢発のウイルスと、早くも、欧米を経由した第2波ウイルスの2種類のウイルスが在るかのようにテレビでは報じてられているが、この点で心配である。
未知なるタンパクとしてScientificに面白いのはORF1aとORF1bである。老生は、この二つのタンパクはコロナウイルスのエンジン部分であると見ている。両方ともRNA依存型ポリメラーゼ (R-d-RP) 活性を持つはずでありーーー筆者の予想ではーーー小さいORF1aは、マイナス鎖の合成を行なって2本鎖RNAを作るポリメラーゼで、大きいほうのORF1bは、キャッピング酵素 (GTase) とPolyAポリメラーゼ活性を持って、プラス鎖のmRNAやゲノムRNAを作るポリメラーゼではなかろうかと思っている。これらのタンパクへ結合して活性を抑える低分子化合物やあるいはmRNAをサイレンスするオリゴ核酸が特異的な抗コロナ医薬品として待たれるところである。果たして、アビガンは、これらポリメラーゼ活性を抑えるだろうかーーー期待したい。
不明なコロナの転写とキャッピング
ポリメラーゼができると、次には、mRNAの合成 (転写) とゲノムRNAの合成 (複製) が始まるが、そのメカニズムは全く不明だ。二本鎖RNAをテンプレートして、ウイルス粒子の形成に必要な構造タンパクを作るために、十種類の短いmRNAが、ゲノムRNAの3'側からつくられるが、このプロセスには、謎が多くてーーー困ったものーーーである。まず第一に、どのmRNAも共通のLeader配列 (72塩基) から始まり、5'末端には、m7GpppAmというキャップが付いているが、それがどうしてできるのか、付くのか、なんと20数年前からわかっていない。第二に、キャッピングのメカニズムが全くわかっていないのである。キャッピングのメカニズムについては、老生が45年前に発見した反応 (図3の右側) が、細胞のmRNAのキャップの作り方として確認されていて、それについての苦労話は、このエッセイシリーズの第5話で書いた。RNAウイルスは、いろんな面で多様性が大きいのだが、特にキャッピングの様式に違いがあり、その解明は決して易しくはない。例えば、永くVSVウイルスのキャップ合成メカニズムは不明であったが、野本研から筆者の友人のAmiya Banerjee博士 (Case Western Reserve Univ.) の研究室へ留学した荻野朝朗博士が、滞米15年間の全てをかけて、最近、ようやくその全工程 (図3の左側) を明らかにした136。このほど、その功積が認められ、今年4月からオハイオ州の名門Toledo大学にAssociate Professorとして、招聘されたことはとても喜ばしい。筆者は、昨年から、荻野君に「次はコロナやエボラのキャッピングをやってくれ」と言っていたのだが、「――まさか、まさかーーー、コロナの問題が、急に、こんなに切迫してくるとは」思いもしなかった。

図3.キャッピング反応メカニズムの多様性 (人物:左側、荻野博士、右側、筆者)
先にも触れたが、コロナでは、mRNA合成やキャッピングの基本になるGTase酵素が一体どの遺伝子にコードされているのかはっきりしていない。VSVウイルスの場合、図3で示すVSV mRNAのキャッピング反応に必要な酵素は、すべて、ウイルスのRNAポリメラーゼの中に組み込まれている。多分、コロナの場合もGTaseはR-d-RPの中に含まれるのだろうと思われる。
次にコロナのmRNAは不連続転写というか、各遺伝子のユニットごとにジャンプするかの如く、飛び飛びに、転写が起こるようであるが、この様式はVSVの場合によく似ている。その際リーダー配列という70塩基ほどの長さのオリゴヌクレオチドが、プライマーとして使われるようである。老生は、そのリーダー配列には、キャップが付いているだろうと想像している (図4135)。実際のところ、この図4は、20年前に筆者がコロナウイルスの転写を理解するうえで載せたモデルだが、まだこの絵を使わなければならないのが残念である。
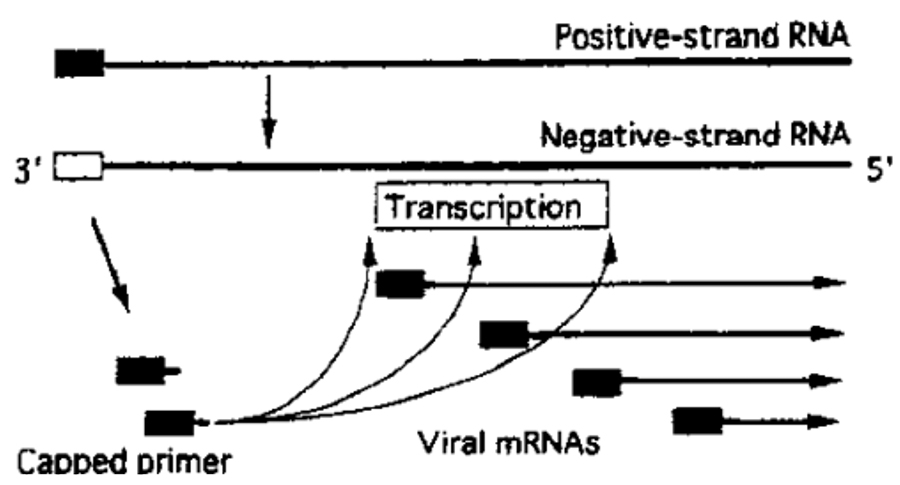
図4.コロナウイルスのLeader 依存性の不連続転写仮説
一方、ゲノムRNAのほうは連続的に30K塩基ほどの完全長のRNAがーーーこれは切れ目なしにーーーやはり、リーダーRNAを先頭にして合成される。一体、mRNAとゲノムRNAの合成の切り替えは、どのようにして行われるのであろうか?これは、大きな、分子ウイルス的な謎でもあるが、創薬のターゲットとしても、有用である。
コロナが及ぼす障害と病理
これまでの研究から、コロナウイルスは、上に述べた特異なメカニズムで宿主細胞へ入り込み増殖を行うことがわかっている。情報は限られたものではあるが、読者諸賢には、抗ウイルス創薬や、感染者を重症化から防ぐアイデアを、是非、出してもらいたい。それについては、別の機会 (第26話) にするとして、ここではウイルス感染がヒトへどのような影響を与えているのか推理してみる。
コロナが感染した細胞では宿主mRNAの合成が特異的に阻害 (shut-off) されてしまうので、細胞の増殖サイクルは止まってしまい、タンパク合成の場はコロナのmRNAに占拠されてしまう。やがて、細胞は数百個の新生ウイルスを抱え、死へと向かうのだが、その前後で、新生ウイルスがBudding (芽生え) により細胞表面から放出される。結局、そのようなことから、コロナウイルスに侵入された細胞は死ぬ。この時、個体レベルでは、感染細胞や死細胞の除去に働くマクロファージが局部へ集まり、炎症性サイトカインや免疫細胞を呼び寄せるケモカインも、この場所から放出されるので、本来、外敵への防御に働くキラーT細胞なども集まってくる。そんなことでウイルスが感染して暴虐を働いた細胞・組織周辺は、死細胞と免疫細胞が混雑した―――膿のような、無残なーーー炎症部位になっていると思われる。これが、ウイルスの感染した、ACE2受容体が多い、肺臓末端の肺胞や毛細血管部分で起こる。そこでは、急性の炎症症状を惹起し、酸素交換ができなくなり、患者は血中の酸素濃度が低下して死に至ることになる。
最近の報告では、肺胞だけではなく、血管を構成している内皮細胞でもACE2受容体を発現していることから、ウイルスが感染した内皮細胞で炎症が起こり、その部分に血小板も集まり血栓を生じるという。言うまでもないが、これらのことは、ウイルスが結合する受容体を多く発現している細胞や組織を中心として、サイトカインストームが起こる可能性を大きくする。感染初期に、匂いや味を感じる機能が損なわれる、とのことであるがーーーやはりACE2を高発現しているーーー鼻腔内上皮の嗅細胞などが最初に感染して死滅するからだと想像される。
これまで縷々述べてきたが、SARS-CoV-2の受容体は、循環血管系に広く分布するACE2であるから、病理は複雑だ。ACE2は、血圧調節に働き、血管内皮細胞の表面に存在しているので、重要な臓器を支える血管系で血栓が生じて、呼吸器不全以外の突然死をおこす原因になっていると想像される。COVID-19の病理を、このように分子レベルで詰めてくると、広く、多くの人に使われている血圧降下薬のACE阻害剤はーーーACE2と結合するので―――案外、コロナウイルスの感染予防に良いかもしれない。SARS-CoV-2の増殖を抑えるアビガンやイベルメクチン、そのほか、サイトカインストームを静めて肺炎や血栓を抑えると思われるアクテムラなどーーー日本発のーーー医薬品の活躍を期待するものであるが、いろんな観点から、死者数の減少に貢献してほしい。
おわりに
このエッセイシリーズでは、昨年暮れに、第24話を書いてから、しばらく配信してないので、―――老生が「病気をしたのか」とか、あるいは「逝ってしまったのか」と思われたかもしれない。お蔭様、元気で働いていたのだが、岐阜大学内に上野義仁教授の核酸化学を基盤にした新ベンチャー (株)GF Mille (ジーエフミレ) を立ち上げて、外国のパートナーとの契約書作りやら、イタリアでの抗コロナ創薬研究の相談を、顧問として、やっていたのでのために、大忙しだった。そんなことで、“てんてこ舞”をしていたため、拙文をまとめる時間がとれなかったのが理由である。鈴木会長から「コロナについて何か書いてください」とプッシュされて、この第25話になった次第だが、一方、コロナ情報は毎日増え続けているので、ポイントを絞って書くことが難しかった。コロナウイルスへの予防薬や治療薬の開発、ならびに「RNA研究者として立ち遅れているPCR検査へも何らかの貢献ができないものか」など、まだ書き残したことが多いのだが、次の第26話に廻すとして、あまり間を置かずに配信しようと思っている。
< 第一回 | 第二回 | 第三回 | 第四回 | 第五回 | 第六回 | 第七回 | 第八回 | 第九回 | 第十回 | 第十一回 | 第十二回 | 第十三回 | 第十四回 | 第十五回 | 第十六回 | 第十七回 | 第十八回 | 第十九回 | 第二十回 | 第二十一回 | 第二十二回 | 第二十三回 | 第二十四回 | 第二十五回 >
References
1. Miura K, Watanabe K, Sugiura M, Shatkin AJ.
The 5′-terminal nucleotide sequences of the double-stranded RNA of human reovirus.
Proc Natl Acad Sci U S A. 1974 Oct;71(10):3979-3983.
PMID: 4530278
2. Furuichi Y.
"Methylation-coupled" transcription by virus-associated transcriptase of cytoplasmic polyhedrosis virus containing double-stranded RNA.
Nucleic Acids Res. 1974 Jun;1(6):809-822.
PMID: 10793759
3. Smith AE.
Modified nucleotides in messenger RNA?
Nature 1974 Aug;9 250(5466) 461.
PDF (237K)
4. Furuichi Y, Miura KI.
Identity of the 3′-terminal sequences in ten genome segments of silkworm cytoplasmic polyhedrosis virus.
Virology. 1973 Oct;55(2):418-425.
PMID: 4742779
5. Furuichi Y.
Discovery of m(7)G-cap in eukaryotic mRNAs.
Proc Jpn Acad Ser B Phys Biol Sci. 2015;91(8):394-409.
PMID: 26460318
6. Furuichi Y, Miura K.
A blocked structure at the 5′ terminus of mRNA from cytoplasmic polyhedrosis virus.
Nature. 1975 Jan 31;253(5490):374-375.
PMID: 163011
PDF (414K)
7. Furuichi Y, Morgan M, Muthukrishnan S, Shatkin AJ.
Reovirus messenger RNA contains a methylated, blocked 5′-terminal structure: m-7G(5′)ppp(5′)G-MpCp-.
Proc Natl Acad Sci U S A. 1975 Jan;72(1):362-366.
PMID: 1054511
8. Wei CM, Moss B.
Methylated nucleotides block 5'-terminus of vaccinia virus messenger RNA.
Proc Natl Acad Sci U S A. 1975 Jan;72(1):318-322.
PMID: 164018
9. Adams JM, Cory S.
Modified nucleosides and bizarre 5'-termini in mouse myeloma mRNA.
Nature. 1975 May 1;255(5503):28-33.
PMID: 1128665
PDF (1.6M)
10. J. Darnell H. Lodish D. Baltimore
Molecular Cell Biology
Scientific American Books, W. H. Freeman and Company. (1986)
11. James E. Darnell.
RNA: Life's Indispensable Molecule
Cold Spring Harbor Laboratory Press. ISBN: 978-1-936113-19-4.
CSH Press
Amazon.co.jp
12. Furuichi Y, Morgan M, Shatkin AJ, Jelinek W, Salditt-Georgieff M, Darnell JE.
Proc Natl Acad Sci U S A. (1975) 72(5):1904-1908.
PMID: 1057180
13. Furuichi Y, Muthukrishnan S, Tomasz J, Shatkin AJ.
J Biol Chem. (1976) 251(16):5043-5053.
PMID: 821947
14. Abraham G, Rhodes DP, Banerjee AK.
Cell. (1975) 5(1):51-58.
PMID: 165900
15. 古市 泰宏
蛋白質・核酸・酵素 (1977) 22(10), 1201-1204.
16. Sommer S, Salditt-Georgieff M, Bachenheimer S, Darnell JE, Furuichi Y, Morgan M, Shatkin AJ.
Nucleic Acids Res. 1976 Mar;3(3):749-765.
PMID: 1272797
17. Amiya K. Banerjee
Proc Natl Acad Sci U S A. (2012) 109(46):18629-18630.
18. Furuichi Y, Shatkin AJ, Stavnezer E, Bishop JM.
Nature. 1975 Oct 16;257(5527):618-620.
PMID: 170541 PDF
19. Gelinas RE, Roberts RJ.
Cell. 1977 Jul;11(3):533-544.
PMID: 884734
20. Thomas M, White RL, Davis RW.
Proc Natl Acad Sci U S A. 1976 Jul;73(7):2294-2298.
PMID: 781674
21. Berget SM, Moore C, Sharp PA.
Proc Natl Acad Sci U S A. 1977 Aug;74(8):3171-3175.
PMID: 269380
22. Krug RM, Morgan MA, Shatkin AJ.
J Virol. 1976 Oct;20(1):45-53
PMID: 1086370
23. Plotch SJ, Krug RM.
J Virol. 1977 Jan;21(1):24-34.
PMID: 833924
24. Bouloy M, Plotch SJ, Krug RM.
Proc Natl Acad Sci U S A. 1978 Oct;75(10):4886-90.
PMID: 283399
25. Furuichi Y, Shatkin AJ.
Proc Natl Acad Sci U S A. 1976 Oct;73(10):3448-52.
PMID: 185613
26. Bouloy M, Morgan MA, Shatkin AJ, Krug RM.
J Virol. 1979 Dec;32(3):895-904.
PMID: 513205
27. Furuichi Y.
Review:Caps on Eukaryotic mRNAs. In: eLS. John Wiley & Sons, Ltd: Chichester.
DOI: 10.1002/9780470015902.a0000891.pub3
28. Krug R.M. and Fodor E.
Webster-Textbook of Influenza
Wiley
Amazon
29. Urushibara T, Furuichi Y, Nishimura C, Miura K.
FEBS Lett. 1975 Jan 1;49(3):385-9.
PMID: 162886
30. Shatkin AJ.
Proc Natl Acad Sci U S A. 1974 Aug;71(8):3204-7.
PMID: 4528644
31. Hickey ED, Weber LA, Baglioni C.
Nature. 1976 May 6;261(5555):71-2.
PMID: 944859
32. Enigma Variations’ of mammalian messenger RNA. (News & Views)
Nature. 1975 May 1;255(5503):9
PDF
33. Muthukrishnan S, Both GW, Furuichi Y, Shatkin AJ.
Nature. 1975 May 1;255(5503):33-7.
PMID: 165427
34. Both GW, Banerjee AK, Shatkin AJ.
Proc Natl Acad Sci U S A. 1975 Mar;72(3):1189-93.
PMID: 165487
35. Both GW, Furuichi Y, Muthukrishnan S, Shatkin AJ.
Cell. 1975 Oct;6(2):185-95.
PMID: 1182800
36. Furuichi Y.
Proc Natl Acad Sci U S A. 1978 Mar;75(3):1086-90.
PMID: 349555
37. Furuichi Y, LaFiandra A, Shatkin AJ.
Nature. 1977 Mar 17;266(5599):235-9.
PMID: 557727
38. Filipowicz W, Furuichi Y, Sierra JM, Muthukrishnan S, Shatkin AJ, Ochoa S.
Proc Natl Acad Sci U S A. 1976 May;73(5):1559-63.
PMID: 1064023
39. Sonenberg N, Shatkin AJ.
Proc Natl Acad Sci U S A. 1977 Oct;74(10):4288-92.
PMID: 270673
40. Sonenberg N, Morgan MA, Merrick WC, Shatkin AJ.
Proc Natl Acad Sci U S A. 1978 Oct;75(10):4843-7.
PMID: 217002
41. Nahum Sonenberg
Biochem Cell Biol. 2008 Apr;86(2):178-83. doi: 10.1139/O08-034.
PMID: 18443631
42. Lazaris-Karatzas A, Montine K.S. Sonenberg N.
Nature. 1990 Jun 7;345(6275):544-7.
PMID: 2348862
43. Lazaris-Karatzas A. Sonenberg N.
Mol Cell Biol. 1992 Mar;12(3):1234-8.
PMID: 1532049
44. Kitamura N, Semler BL, Rothberg PG, Larsen GR, Adler CJ, Dorner AJ, Emini EA, Hanecak R, Lee JJ, van der Werf S, Anderson CW, Wimmer E.
Nature. 1981 Jun 18;291(5816):547-53.
PMID: 6264310
45. Nomoto A, Lee YF, Wimmer E.
Proc Natl Acad Sci U S A. 1976 Feb;73(2):375-80.
PMID: 174106
46. Lee YF, Nomoto A, Detjen BM, Wimmer E.
Proc Natl Acad Sci U S A. 1977 Jan;74(1):59-63.
PMID: 189316
47. Nomoto A, Kitamura N, Golini F, Wimmer E.
Proc Natl Acad Sci U S A. 1977 Dec;74(12):5345-9.
PMID: 202952
48. Nomoto A, Detjen B, Pozzatti R, Wimmer E.
Nature. 1977 Jul 21;268(5617):208-13.
PMID: 196204
49. Wimmer E.
Cell. 1982 Feb;28(2):199-201.
PMID: 7060125
50. Etchison D, Milburn SC, Edery I, Sonenberg N, Hershey JW.
J Biol Chem. 1982 Dec 25;257(24):14806-10.
PMID: 6294080
51. Kräusslich HG, Nicklin MJ, Toyoda H, Etchison D, Wimmer E.
J Virol. 1987 Sep;61(9):2711-8.
PMID: 3039165
52. Lee KA, Sonenberg N.
Proc Natl Acad Sci U S A. 1982 Jun;79(11):3447-51.
PMID: 6954488
53. Sonenberg N, Pelletier J.
Bioessays. 1989 Nov;11(5):128-32.
PMID: 2556117
54. Marilyn Kozak and Aaron Shatkin
J. Biol. Chem. 1976 Jul.; 251(19):4259-4266.
PMID: 932032
55. Marilyn Kozak and Aaron Shatkin
J. Biol. Chem. 1977 Oct.; 252(19):6895-6908.
PMID: 893449
56. Marilyn Kozak
Nature. 1977 Sep; 269: 390-394.
PMID: 909586
57. Marilyn Kozak
Annu. Rev. Cell Biol. 1992; 8:197-225. Review
PMID: 1335743
58. Marilyn Kozak
Mol. Cell Biol. 2001 Mar;21(6): 1899-1907. MiniReview
PMID: 11238926
59. Robert Schneider
Mol. Cell Biol. 2001 Dec;21(23): 8238-8246. Letter to Editor
PMID: 11710333
60. Marilyn Kozak
Mol. Cell Biol. 2001 Dec;21(23): 8246-8256. Author’s Reply
61. Marilyn Kozak
Nucleic Acids Res. 2001 Dec 15; 29(24):5226-5232.
PMID: 11812856
62. Marilyn Kozak
Gene. 2007 Nov 15; 403(1-2): 194-203.
PMID: 17888589
63. 古市泰宏 Marilyn Kozak
蛋白質核酸酵素 1977, 22(3), p236-240.
64. KozakM and Nathans D.
Bacteriol Rev. 1972 Mar;36(1):109-34. Review.
PMID: 4555183
65. Saiki RK, Scharf S, Faloona F, Mullis KB, Horn GT, Erlich HA, Arnheim N.
Science. 1985 Dec 20;230(4732):1350-1354.
PMID: 2999980
66. Saiki RK, Bugawan TL, Horn GT, Mullis KB, Erlich HA.
Nature. 1986 Nov 13-19;324(6093):163-6.
PMID: 3785382
67. Mullis K, Faloona F, Scharf S, Saiki R, Horn G, Erlich H.
Cold Spring Harb Symp Quant Biol. 1986;51 Pt 1:263-73.
PMID: 3472723
68. Mullis KB, Faloona FA.
Methods Enzymol. 1987;155:335-50.
PMID: 3431465
69. Gelfand DH and White TJ.
PCR Protocols: A Guide to Methods and Applications (Edited by Innis MA, Gelfand DH, Sninsky JJ, White TJ, Academic Press, San Diego), 1990;p129-141.
Amazon
70. Nuss DL, Furuichi Y, Koch G, Shatkin AJ.
Cell 1975;6:21-27.
PMID: 1164732
71. Nuss DL, Furuichi Y.
J Biol Chem. 1977 May 10;252(9):2815-21.
PMID: 16003
72. Yamakawa M, Furuichi Y, Nakashima K, LaFiandra AJ, Shatkin AJ.
J Biol Chem. 1981 Jun 25;256(12):6507-14.
PMID: 7240222
73. Ogino T, Yadav SP, Banerjee AK.
Proc Natl Acad Sci U S A. 2010 Feb 23;107(8):3463-8.
PMID: 20142503
74. Abraham G, Rhodes DP, Banerjee AK.
Nature. 1975 May 1;255(5503):37-40.
PMID: 165428
75. Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Yazaki Y, Goto K, Masaki T.
Nature. 1988 Mar 31;332(6163):411-5.
PMID: 2451132
76. Arai H, Hori S, Aramori I, Ohkubo H, Nakanishi S.
Nature. 1990 Dec 20-27;348(6303):730-2.
PMID: 2175396
77. Sakurai T, Yanagisawa M, Takuwa Y, Miyazaki H, Kimura S, Goto K, Masaki T.
Nature. 1990 Dec 20-27;348(6303):732-5.
PMID: 2175397
78. Adachi M, Yang YY, Furuichi Y, Miyamoto C.
Biochem Biophys Res Commun. 1991 Nov 14;180(3):1265-72.
PMID: 1719979
79. Breu V, Hashido K, Broger C, Miyamoto C, Furuichi Y, Hayes A, Kalina B, Löffler BM, Ramuz H, Clozel M.
Eur J Biochem. 1995 Jul 1;231(1):266-70.
PMID: 7628480
80. Summers MD, Anderson DL.
J Virol. 1972 Apr;9(4):710-3.
PMID: 5021310
81. 宮本力、古市泰宏
蛋白質・核酸・酵素、35、2598-612 (1990)
PMID: 2176306
82. Satoh M, Miyamoto C, Terashima H, Tachibana Y, Wada K, Watanabe T, Hayes AE, Gentz R, Furuichi Y.
Eur J Biochem. 1997 Nov 1;249(3):803-11.
PMID: 9395330
83. 宮本力
BIO medica 5, 1277-1281 (1990)
84. Zaug AJ, Cech TR.
Cell. 1980 Feb;19(2):331-38.
PMID: 7357611
85. Grabowski PJ, Zaug AJ, Cech TR.
Cell. 1981 Feb;23(2):467-76.
PMID: 6162571
86. Wild MA, Gall JG.
Cell. 1979 Mar;16(3):565-73.
PMID: 455443
87. Cech TR, Zaug AJ, Grabowski PJ.
Cell. 1981 Dec;27(3 Pt 2):487-96.
PMID: 6101203
88. Peltz SW, Brown AH, Jacobson A.
Genes Dev. 1993 Sep; 7(9):1737-54.
PMID: 8370523
89. Karousis ED, Nasif S, Mühlemann O.
Wiley Interdiscip Rev RNA. 2016 Sep;7(5):661-82.
PMID: 27173476
90. Chang JC, Temple GF, Trecartin RF, Kan YW.
Nature. 1979 Oct 18;281(5732):602-3.
PMID: 492326
91. Maquat LE, Kinniburgh AJ, Rachmilewitz EA, Ross J.
Cell. 1981 Dec;27(3 Pt 2):543-53.
PMID: 6101206
92. Matsumoto T, Shimamoto A, Goto M, Furuichi Y.
Nat Genet. 1997 Aug;16(4):335-6.
PMID: 9241267
93. Yamabe Y, Sugimoto M, Satoh M, Suzuki N, Sugawara M, Goto M, Furuichi Y.
Biochem Biophys Res Commun. 1997 Jul 9;236(1):151-4.
PMID: 9223443
94. Thermann R, Neu-Yilik G, Deters A, Frede U, Wehr K, Hagemeier C, Hentze MW and Kulozik AE.
EMBO J. 1998 Jun 15;17(12):3484-94.
PMID: 9628884
95. 山下暁朗
実験医学、30、1471-80 (2012).
96. Kurosaki T, Maquat LE.
J Cell Sci. 2016 Feb 1;129(3):461-7.
PMID: 26787741
97. Dahm R.
Dev Biol. 2005 Feb 15;278(2):274-88.
PMID: 15680349
98. Dahm R.
Hum Genet. 2008 Jan;122(6):565-81.
PMID: 17901982
99. Shapiro R, DiFate V, Welcher M.
J Am Chem Soc. (1970) 92(2):422-424.
100. Hayatsu H, Wataya Y, Kai K.
J Am Chem Soc. (1970) 92(3):724-726.
101. Hayatsu H, Wataya Y, Kai K, Iida S.
Biochemistry. (1970) 9(14):2858-2865.
PMID: 5459538
102. Frommer M, McDonald L, Millar DS, Collins CM, Watt F, Griggs GW, Molloy PL, Paul CP.
Proc Natl Acad Sci U S A. (1992) 89:1827-1831.
PMID: 1542678
103. Elson D, Chargaff E.
Experientia. 1952 Apr 15;8(4):143-5.
PMID: 14945441
104. Chargaff E, Lipshitz R, Green C.
J Biol Chem. 1952 Mar;195(1):155-60.
PMID: 14938364
105. 三浦謹一郎
核酸の化学
東京科学同人. (1962)
106. Nirenberg MW, Mattaei JH.
Proc Natl Acad Sci U S A. 1961 Oct 15;47:1588-602.
PMID: 14479932
107. Grunberg-Manago M, Ochoa S.
J Am Chem Soc. (1955) 77(11):3165-3166.
108. Nirenberg MW, Mattaei JH.
The 5th International Congress of Biochemistry, Moscow August 1961
109. Singer MF, Heppel LA, Hilmoe RJ.
J. Biol Chem. (1960) 235:738-50.
PMID: 14447077
110. Berg P, Baltimore D, Brenner S, Roblin RO, Singer MF.
Science. (1975) 188:991-4.
PMID:1056638
111. Tsugita A, Fraenkel-Conrat H, Nirenberg MW, Matthaei JH.
Proc Natl Acad Sci U S A. (1962) 48:846-53.
PMID:13922861
112. 西村 暹
蛋白質・核酸・酵素、51、815-22 (2006).
113. Takanami M.
Biochim. Biophys. Acta. (1962) 55: 132-138.
PMID:13919134
114. Kaji H, Kaji A.
Biochem. Biophys. Res. Commun. (1962) 48:846-53.
115. Leder P, Nirenberg M.
Proc Natl Acad Sci U S A. (1964) 52:420-427.
PMID:14206609
116. Nirenberg M, Leder P.
Science. (1964) 145: 1399-1407.
PMID:14172630
117. Sato K, Egami F.
J. Biochem. (1957) 44: 753-767.
118. Holley RW, Everett GA, Madison JT, Zamir A.
J. Biol. Chem. (1965) 240:2122-2128.
PMID:14299636
119. 國中 明
蛋白質・核酸・酵素、11、1253-6 (1985).
120. Söll D, Ohtsuka E, Jones DS, Lohrmann R, Hayatsu H, Nishimura S, Khorana HG.
Proc Natl Acad Sci U S A. (1965) 54:1378-85.
PMID:5325653
121. Nishimura S, Jacob TM, Khorana HG.
Proc Natl Acad Sci U S A. (1964) 52:1494-501.
PMID:14243524
122. Nishimura S, Jones DS, Khorana HG.
J Mol Biol. (1965) 13:302-24.
PMID:5323614
123. Imai M, Richardson MA, Ikegami N, Shatkin AJ, Furuichi Y.
PNAS (1983) 80: 373-377.
PMID:6300836
124. Imai M, Richardson MA, Ikegami N, Shatkin AJ, Furuichi Y.
Double-stranded RNA Viruses. Elsevier/North-Holland. (1983) 15-26.
125. Both GW, Siegman LJ, Bellamy AR, Ikegami N, Shatkin AJ. Furuichi Y.
J Virol. (1984) 51, 97-101.
PMID:6328048
126. Okada Y, Richardson MA, Ikegami N, Nomoto A, Furuichi Y
J Virol. (1984) 51, 856-9.
PMID:6088807
127. Richardson MA, Iwamoto A, Ikegami N, Nomoto A, Furuichi Y.
J Virol. (1984) 51, 860-2.
PMID:6088808
128. Lin M, Imai M, Bellamy AR, Ikegami N, Furuichi Y, Summers D, Nuss DL, Deibel R.
J Virol. (1985) 55, 509-12.
PMID:2991576
129. Lin M, Imai M, Ikegami N, Bellamy AR, Summers D, Nuss DL, Deibel R, Furuichi Y.
J Viro. Methods. (1987) 15, 285-9.
PMID:3034943
130. Tano H, Fan K, Kitajima MA, Kasai K, Tamatsukuri S, Furuichi Y, Hayashi T, Kondo M, Imai M.
J Clin Microbiol. (1995) 33:2489-91.
PMID:7494056
131. Arella M., Lavallée C, Belloncik S and Furuichi Y.
J Virol. (1988) 62:211-7.
PMID:3275433
132. Chen Y, Guo D.
Virol Sin. (2016) 31(1):3-11.
PMID:26847650
133. Lai MM, Cavanagh D.
Adv Virus Res. 1997;48:1-100.
PMID:9233431
134. Kim D, Lee JY, Yang JS, Kim JW, Kim VN, Chang H.
Cell. 2020 Apr 18. pii: S0092-8674(20)30406-2. doi: 10.1016/j.cell.2020.04.011. [Epub ahead of print]
PMID:32330414
135. Furuichi Y, Shatkin AJ.
Adv Virus Res. 2000;55:135-84.
PMID:11050942
136. Ogino T, Green TJ.
Front Microbiol. 2019 Jul 10;10:1490.
PMID:31354644



