RNAは未知の部分が多く、まだまだドラマが期待できる、興味の尽きない領域だ
DNAやタンパク質の品質管理
「生体を構成する物質の品質管理」なんていうと、とても重苦しい。しかし、細胞にとっては非常に重要で、DNAやタンパクなどの品質を管理するシステムがあることはよく知られている。遺伝子DNAの修復は、最も重要で、修理方法もいくつかある。修理不能であれば、細胞ごと消去する。この操作がシッカリできてないと細胞は癌化したりする。タンパクの品質管理には、立体構造の崩れをチェックして、手直しするシャペロンというタンパクがある。シャペロンは、「不良品!」というタグをつける。タグはユビキチンという小さなタンパクだ。このタグが不良タンパク分子の外側に突き出ているリジンに付くと、細胞質内にあるプロテアソームという筒状のマシーンへ運ばれ分解される。かくして、古いタンパクは消失し、新しい分子に置き換えられる。
メッセンジャーRNAの品質評価:NMD現象
メッセンジャーRNA(mRNA)のような、寿命が短く、遺伝子のメッセージを“伝えるため”の、“使い捨てRNA”では、安定/不安定の懸念はあったが、品質評価は想定されていなかった。ところが、mRNAにも品質評価を行うシステムがあり、正しくタンパクを作れないmRNAは、「壊される」、という不思議な現象が、1980年から90年代にかけて、限られた数の研究者によって発見されていた。そして、研究が進むにつれて、このRNAの品質評価・管理が細胞にとって非常に重要であることがわかってきた。発見は古いが、メカニズムが確定していないから。ノーベル賞はまだ出ていない。
この稿で紹介するmRNAの品質評価・管理のメカニズムは、NMD(Nonsense-Mediated mRNA Decay)と呼ばれてきた。先に、“限られた数の研究者によって発見され”と書いたが、米国のLynne Maquat(リン)が、その代表的な一人であり、彼女は現在もこの分野を牽引しているリーダーである。ところで、実は筆者も、90年代に、このNMD現象に出会った数少ない一人であり、その不可解な現象に大いに当惑した。そして、ヒトのNMDに取り組んでいるのは、独り、米国のリンMaquat女史だけであることを知ったのである。そこで、米国へ出かけ、あるシンポジュームでリン女史と会った。大ホールの最前席に隣り合って座り、この不思議な現象について話をした。マリリンの「コザックルールの発見」については第8話で紹介し、マルチーナの「ボセンタン創薬」については第11話で紹介したので、「エッ今度も女性ですか」と訝るかもしれないが、リンは、まさに凛(リン)とした、背の高い、独身で、気の強そうな美人だった。あの日、彼女は黒いワンピースがよく似合った。―――あれから、20年以上たっているが、今の彼女は、さてどうだろうか。
研究は進んだが、複雑で、すっきりしないNMDの謎
さて、話をNMDへ戻すがーーー、不思議な現象として見出したものの、実は、筆者はこの問題から逃げだしたのである。リンとの会話から、不良mRNAを認識して壊すという現象のメカニズムは、「タンパク合成とスプライシングも絡んでいるらしい」ことがわかり、問題は「複雑すぎる」と思ったからである。タンパク合成中のリボソームが早期終止コドン(Premature Termination Codon: PTC)に出会うとーーー「このmRNAは終始コドンが早すぎる。産物のタンパクは、短くて使い物にならない」などと判断して、「壊してしまう」のであるが、それがどうして起こるのだろうか(図1)。折角、面白いことを発見しても、技術が及ばず、解明できないと予見して、尻込みすることもある。このNMDは、私にとって、まさにそれだったーー-謎が深すぎるのである。ちなみに、NMDという名前はマサチューセッツ大で酵母のmRNAを研究していたアランJacobsonがPTCを持つmRNAが早く壊れることを観察して付けた名前である88。そして、このネーミングのNMDは「ナンセンスコドンが原因の不良mRNAの分解」として充分な理解を果たしてきた。しかしながら、NMDによるmRNAの分解が、正常なmRNAにも起こるということが判ってきたので、名前がピッタリしなくなってきたらしい。実際、ヒトの遺伝子疾患やがん発生に関わる遺伝子変異の1/3は、タンパク合成にとっては障害となる早期終止コドンを持つナンセンス変異であり、日常、頻繁に作られている免疫グロブリンmRNAやT細胞レセプター(TCR)mRNAはーーーランダムなDNAの組み換えを介して作られるためーーーその3分の2はPTCを含むナンセンスなmRNAである。そのような不毛なmRNAは全体の10%ほどもあるらしいが、それらを排除するために、細胞はNMDをフル回転させていると思われる。
しかしながら、メカニズムを探る研究が進むにつれて、正常なmRNAであっても、細胞の状態によっては、「NMDらしきことが起る」ことが、最近の20年間の研究から判ってきてーーー事情は複雑になって来た。生物種によってもNMDのメカや重要度が異なるというから、複雑さは拡大し、NMDは現在でも議論が続く未解決の分野であると言っても良さそうだ。最近では、「いっそ、NMDという名前を変えようか」という提案すらも出てきている。しかし、筆者はNMDという名に愛着があるので、「変えてほしく」ないと思っている。
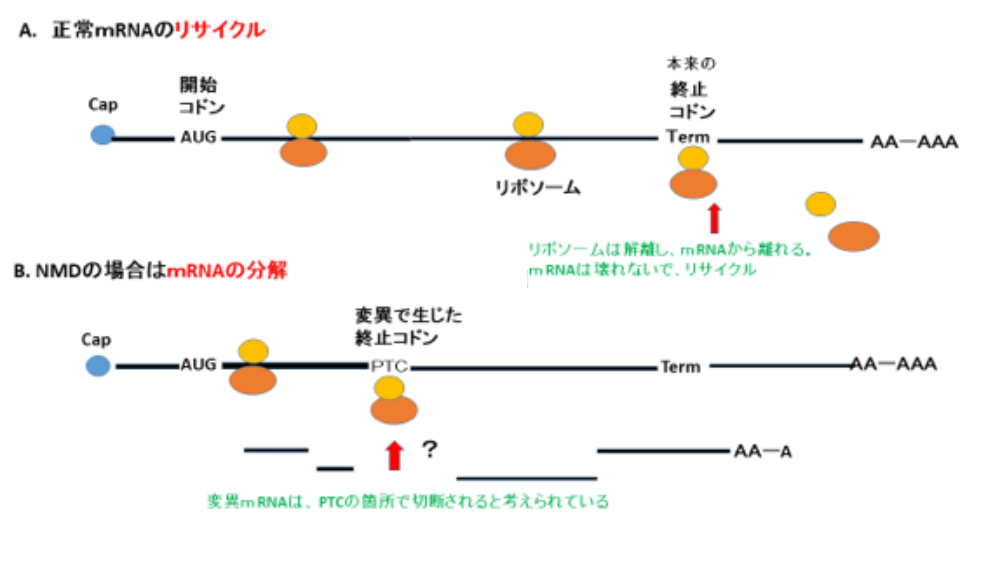
図1: 早期終止コドン(PTC)を持つmRNAを分解するNMD
ハエではPTC周辺でのSMG6ヌクレアーゼによる切断がおこるが、ヒトではそれに加え、両末端からの分解もあるとのことであり複雑だ。
ただ忘れてはならない重要なことがある、それは、NMD現象は、細胞質で起こり、タンパク合成に依存した現象であることである。だから、タンパク合成を抗生物質などで阻害すれば、NMDによるmRNA分解は起こらない。以前は、NMDのメカニズムは、タンパク合成の際に、リボソームが進んでいって、PTCと出会うとき、「アッこれはいけない」と気が付きmRNAを分解すると考えられてきた。しかし、その後、研究が進んできて、最近の、2016年発表のオリバー・ミュールマン(Oliver Muhlemann)のレビューによれば、正しいmRNAであってもタンパク合成の終止段階でグズグズしているとmRNAは壊されるとのことである89。そんなことで、ミュールマンは、NMDに替えて「Translation-dependent mRNA degradation that requires UPF1 and SMG1,6,7」という名前を提唱している。この稿では、この不思議な現象が発見された30数年前に立ち戻って、発見者達の驚き、悩み、問題解決への努力について回顧し、古典的といわれるかもしれないが「早期終止コドンPTCに基づくNMD」によるmRNAの分解について紹介したい。
最初の素朴な発見
1979年、高等生物のmRNAの安定性に関して、キャップとポリAが重要であること以外、目新しい報告はなかったが、奇妙な現象がβサラセミアという白血病で見つかっていた。特に重症なβ⁰サラセミア患者では、細胞中に「βグロビンのmRNA量が少ない」ということが、この病気の研究者達には知られていた。「遺伝病患者の、変異を持った遺伝子からできるmRNAの量が少ない」という観察である。最初の報告は、カリフォルニア大学総合病院で、患者の血液成分に関する研究を行っていた Changと Kanという韓国系の名前の研究者からのものである90。彼らは、患者の二組の遺伝子に共通して、AAGというリジンを作るべき17番目のコドンが、UAGという終止コドンに変わっていて、この「早すぎる終止コドンPTC」のために、タンパク合成は早期に止まることを報告したーーーだから、正常タンパクは出来ない。しかし、彼らは、何故か、PTCを持つ変異mRNAの量までも少ないことに気が付いた。正常なグロビンが出来ない理由はわかるが、その、mRNAが少ない理由がわからない。核内には前駆体RNAがあり、期待するサイズのmRNAはできるが、その量が少ないのだ。彼らは、グロビンmRNAの生成に際して、プロモーターが悪くて転写量が少ないのか、あるいは、スプライシングなどのプロセシングがうまくゆかないからではないか――と、いろいろ予想したがーーどれも当たってはいなかった。そう、「mRNAはできていたのだが、早く壊れていたのだった!」。
しかし、ChangとKanの興味は、患者を救うことにあったから、終止コドンであるUGAを読む転移RNA(tRNA)を使えば、グロビンタンパクが出来るのではないかと考えて、その方向の研究へ舵を切った。実際、翌年、発表したNature論文では、終止コドンUAGが読めるtRNAを、タンパク合成系へ加えると、変異を越えてグロビンが作られるデータを示している。しかしーーーそれでは、サイエンスとして面白くない。その論文中でも、変異グロビンmRNAの量が少ないことを述べてはいるが、―――本当はこちらの方が大きい魚だったのだ。
リン Maquat
それから数年たって、1981年、このグロビンmRNAの不思議を明らかにして、俎上に載せた女性がいる。ウィスコンシン大のリンMaquat(現ロチェスター大)である。彼女は、変異を持つβグロビンmRNAは、正常なmRNAより不安定であることを、ハッキリさせた。彼女は、クルド系ユダヤ人患者のβサラセミア骨髄細胞を使い、3H放射性ヌクレオシドを細胞へ取りこませ、βグロビンの前駆体RNAを短時間(30分間)パルスラベルする。その後、ラベルされたRNAを非放射性ヌクレオチドでチェイスして、―――最初にラベルした前駆体RNAのーーーその後の運命を調べたのである91。この実験は正解だった。リンはこの実験で、NMDの現象を、RNAの量や分解時間でスッキリ定量化したのである。NMDというわかりやすい名の、名付け親でもあるアランJacobsonは、酵母のmRNAについて研究を行い、PTCの位置がmRNAの上流にある方がRNAは壊れやすいcis効果や、UPF1というRNAヘリカーゼタンパクがtrans効果としてNMDに必要であるということなど、先駆的な報告をしているが、ここでは、ヒトの病気におけるNMDに絞って話を進めたい。
1990年代に入って、日本で、ヒトの遺伝病であるウエルナー症候群の研究をやっていた筆者のグループでも、「変異を持ったmRNAが、何故か、無くなっている」という不思議な現象を観察していた。ヒトの遺伝病mRNAへのNMD現象に関して、順番で言えば、Chang/Kanとリンに継いで、世界で第3番目だったかもしれない。筆者らはこの現象を不思議に思い、最初Nature誌へ論文を送ったが、レフリーから「そんなはずはない。ヌクレオチドが一個変わったぐらいではmRNAが不安定になるとは思えない。貴兄は、mRNAの5'末端のキャップが安定性に重要と言っていたではないか。メカニズムを明らかにしてから再投稿しなさい」という厳しいコメントがきてReject(拒絶)されてしまった。我々も判らなかったが、レフェリーもこの問題の不思議さが、よく理解できなかったのだ。確かに、ヌクレオチドが1個変わったとか、タンパク合成が早く終わるということぐらいでーーmRNAが分解されるとは、想像が及ばなかったーーのである。
ウエルナー症候群患者の細胞中で変異mRNAが無くなる不思議
最初にNMDに出会った日本人は山邉裕香子さんであったろう。裕香子さんは、北里大学薬学部(井村伸正教授、野本明男准教授)で修士課程を終え、1993年から、私が所長だったエイジーン研究所へ就職し、ウエルナー症候群の研究を進めていた。彼女はウエルナー症候群の原因となるWRNヘリカーゼ遺伝子の転写がSP1プロモーターから行われていることを調べ上げ、立派な論文をMol. Cell Biol. 誌に発表したが、その過程で、患者の細胞からRNAを抽出し、ノーザンブロット法でmRNAの長さと量を調べたところ、該当するmRNAが全く見当たらないことに気が付いた。この時の、驚きの発見とは、どんなものであったか、実例で紹介しよう(図2、レーン1の矢印の場所に期待するmRNAに注目)。つまり、患者の細胞にはWRNヘリカーゼをコードするmRNAが全くないのである。一方、正常人細胞のmRNAを調べると(レーン5)、予想される長さのmRNAがタップリあることがわかる。確認のため、患者の両親や姉の細胞から得たmRNAを分析してみると、正常人のWRN mRNAよりは半分以下で、少ないことが判った(レーン2、3)。患者の親族は、2組の遺伝子のうち片方にだけ変異を持つ方々である。この家系以外の患者親族の細胞でも、変異のタイプは違うが、やはり、WRN mRNAは少ないことが判った(レーン4)。これらの結果には、裕香子さんも私も、全く面食らってしまった。これは、一体、どうしたことだろうか?
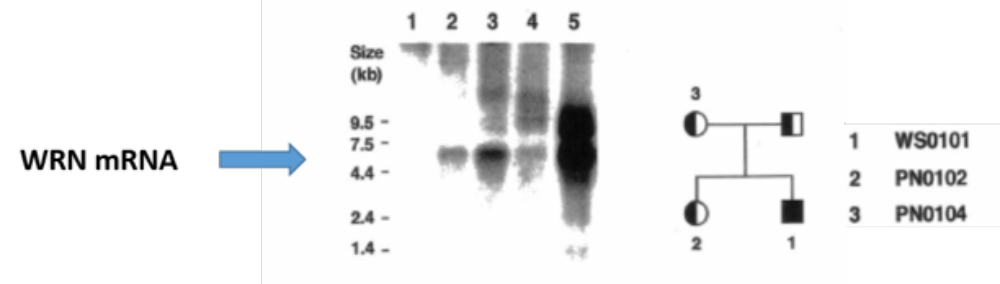
図2: NMDの実例:ウエルナー症患者と家族のWRN mRNA量の測定
(1: 患者、2: 患者の姉、3: 患者の母、4: 別の患者の親族(変異タイプ6を持つ)、5: 正常人)
日本人ウエルナー患者の遺伝子変異を調べてみると、20種類ほど変異タイプがあることが判った。そして、その原因となるDNAヘリカーゼ(WRNヘリカーゼ)は、βグロビンよりはるかに大きな(分子量16万ダルトン)タンパク質である。mRNAも35個のエキソンからなり、3個のエキソンからなるグロビンmRNAより長く、複雑であるが、患者の遺伝子変異のほぼ全てがmRNAのいろんな場所にPTCをつくっていた(図3)。患者のすべてについてmRNAを調べた訳ではないが、その変異の場所やタイプに関わらず、NMDが働いて、WRN mRNAが消失しているらしいのである。これに加え、WRNヘリカーゼは、C末端に核移行シグナル(Nuclear Localization Signal: NLS)があり、短い不完全タンパクでは、NLSを欠くため、仕事場である核へ行けないということもわかった。したがって、NMDとNLSの両方の原因で、患者の核内にはWRNヘリカーゼが無く、ーーーその結果、患者の細胞では、DNA修復が満足にできないため、変異のタイプに関係なく、ゲノム不安定と早老症状を呈するということが理解できた92。

図3: ウエルナー症患者のWRN mRNAのPTCの位置と、想定される不完全タンパク。カッコ内の1、4、6は図2の患者や親族がもつ変異のタイプを示す。
もう少し、先ほどのウエルナー症候群の家族について見てみよう。図2中の患者の父親は、2組の遺伝子の片方にMutation-1という変異を持ち、母親も片方の遺伝子にMutation-4という変異を持っていた。患者の姉は、父親と同じMutation-1という変異だった。患者は、劣性遺伝病であるから、二組の遺伝子の片方に父方のMutation-1を持ち、他方に母方のMutation-4の変異を持っていて、そのことにより、WRNヘリカーゼmRNAはまったく無い(図2,レーン1)。一方、母親 (レーン3)や姉(レーン2)は、正常なmRNAはあるが、正常人にくらべて半分以下と少ないことが気になるーーー何故なのだろう?このデータを見て、由香子さんと筆者は考え込んでしまった。細胞内には、変異を持つmRNAを狙って壊す未知のシステムがあるらしいが、これが作動して、勢い余って、正常の mRNAも壊しているように見えるのである。幸いなことに、片方の遺伝子にだけ変異を持つ両親や親族は、僅かではあっても、正常のWRN mRNAがあるのでーーー保因者ではあってもーーーウエルナー症候群の患者にはならない。
ところで、PTC変異を持つmRNAはどうして消えてしまったのだろうか?この問題は面白そうであるが、とても難しそうだ。そんなことで、裕香子さんと私は、この問題を、これ以上、追及しないことにした。逃げたのである。ただ、この不思議な現象だけは「記録として報告しておこう」と、Nature誌で拒絶された論文を、こんどは、BBRC誌に発表することにした93。裕香子さんは、この論文も入れて、博士号の学位を得ることができたが、心残りは続いた。
どうやって早期終止コドン(PTC)と正常な終止コドンを見分けるのか?
1998年には、二つの大きな発見があった。ひとつは、RNA干渉(RNAi: RNA interference)という、特定の遺伝子の発現を抑える技術の発見である。RNA干渉は、小さなRNAが配列特異的にmRNAを分解する現象であり、利用範囲の広い、インパクトの大きな発見であった。このため、発見者の米国人ファイアー博士とメロー博士には、2006年にノーベル生理学・医学賞が与えられている。この新技術を使うと、特定の遺伝子の発現を選択的に抑えることができるので、細胞を使って、遺伝子の発現を、一つ一つ、つぶしながらいろんな生物現象に関係するタンパクを細胞レベルの簡単な実験で調べることができる。
もう一つは、NMDに関するもので、ドイツのフンボルト大のThermannらによる発見である94。彼らは、HeLa 細胞中へ、正常人やPTCを持つ患者のβグロビンゲノムDNA断片を組み込んだ発現ベクターを入れてーーーゲノムDNA断片に色々細工を加えながらーーーmRNAが、細胞の核内で転写され、スプライシングを受け、細胞質へ移動し、タンパク合成に使われる様子やNMDについて調べた。その結果、いろんなことがハッキリした。
- NMDには、RNAが事前にスプライシングを受けていることが必要、
- PTCのある場所より下流に~50ヌクレオチド(以上の間隔で)スプライシングの際のエキソン・エキソンJunctionがあること、
- NMDが起るには、mRNAがタンパク合成のプロセスに入っていることが必要、
などである。
これらのことは、これまでに、正常のmRNAの終止コドンは、そのほとんどが最後のエキソン上にあるーーーつまり、その後ろにはエキソン・エキソンJunctionがないーーーことが、知られていたが、そのこととよく合う。すなわち、正常の終止コドンだろうがPTCだろうが、終止コドンには差は無くて、そのうしろにエキソン・エキソンJunctionというタグがあるか、無いかで、mRNAはーーー最初のタンパク合成の際にーーーNMDにより、壊されるか、再使用されるかが決まるらしいということである。
この結果、多くのスプライシング研究者がNMD研究へ参画することになり、研究分野は拡大し,競争は激しくなった。勿論、1998年発見のRNA干渉技術は、その後、大いにNMD研究に役立ち、NMDに関与するタンパク質10数種のタンパク質が判ったが、中でも重要であると思われるのがRNAヘリカーゼ活性を持つUPF1とか、エンドヌクレアーゼ活性を持つSMG6やポリA鎖を短小化するSMG7である。このほか、エキソン・エキソンJunction上のタグの実態が明らかになった。そこには、4種類のタンパク質よりなるエクソン・ジャンクション・複合体(Exon Junction Complex: EJC)というタンパク粒子が付いていていたのである。冒頭に紹介した「ユビキチンの不良品タグ」のような役割が期待されるところであるが、残念ながら、現在に至るまで、仮説は多々あるが、EJCがどのように働き「誰がどのように」mRNAを壊すのかははっきりしていない。2012年に、横浜市立大の山下暁朗さんが実験医学に、この間の歴史やトピックスについて、自身の発見も含めてレビューを書いていて、そのメカニズムを利用した医薬品開発についても書いているので参照されたい95。
EJC粒子はmRNAを核から細胞質へ移動することを助けるので、ほぼ全てのmRNAにはEJCがついているであろう。例えば、先に述べた、ウエルナー症候群の原因となるWRN mRNAなどは、35個のエキソンからなっているので、スプライシングのマーカー・タグとして最多34個のEJC粒子がmRNAの上に並ぶことになり、PTCがあれば、確実にNMDは起るであろう。このほか、mRNAには、キャップ結合タンパクやポリA結合タンパクもmRNAの末端に結合して、リング状になっているから、mRNAは単純に直線で一本に書いているようなものではないらしい。mRNAはタンパク合成因子とEJC粒子からなるーーー数珠を丸めたようなーーー形態を想定したらよいようであり、EJC粒子は最初にやってくるリボソームによって除かれるということらしい。こんな新しい概念もNMDの研究から生まれてきた。
まだ、NMDは混沌としていて、未解決の問題が多い
それから20年たって、2017年、NMD研究の現状を知りたくて、スイス・ベルン大のオリバーMuhlemannらが書いたレビュー(2016年版)を読んでみて、そして不審に思ったので、(会ったことはないが)オリバーにメールで聞いてみた。すると何と驚いたことに、彼によると、NMDの分野はまだ混沌としていて、依然、未解決の問題が多く、NMDの名前はごく一部の現象を示しているだけなので、「NMDの名前も変えた方が良いのかもしれない」という強烈な答えが返って来た。この問題を、もっと詳しく説明したいから電話番号を教えてくれというが、丁寧にお断りした。多分いろんな可能性や例外があるのだろう。ただ、WRN mRNAのような変異を持つmRNAに関して、「mRNAの品質管理のためのNMD現象」が起こっているのは間違いない。しかし、それが、正常なmRNAへも起っていて、「細胞の生体機能の調節に働いているらしい」とのことである。昔、裕香子さんと書いた論文に、「変異を持つmRNAを狙って壊す未知のシステムがあるようだが、それが勢い余って、正常のmRNAをも壊しているように見える」と記述したが、案外、的外れではないかもしれない。細胞の状態によっては、特定のmRNAを壊すデ・キャッピングやら、ポリA短小システムや、miRNAが介在する調節システムもあるので、古典的なNMDメカニズムがそれにオーバーラップして、理解が複雑になっているのかもしれない。ロチェスター大のリンMaquatの研究室にいる黒崎辰昭博士がこれらの問題に取り組み、2016年にレビューを書いているので、興味ある方は参考にされたい96。
深い謎、一体、何のためのNMDなのか?
本来のNMDの定義では、異常なmRNAを分解して、短い異常タンパクをリボソームに作らせなくするということだった。核内での、mRNA前駆体のスプライシングでは、エラーが頻繁に起こるため、その間違いを正すために、Alternative splicing産物のうちの異常なmRNAを排除する機能として重要であろう。WRN mRNAのように35回もスプライシングを正確にやらないと正しいmRNAはできないとなれば、エラーは多かろうと思われる。また、正しくない転写サイトから作られたmRNA(転写因子のエラーにより作られるキャップをもったRNA)を除くためにも働いており、正常細胞においても、mRNA全体の10%ほどがNMDのメカニズムで分解されているとのことである。その、それぞれの異常mRNAについて、どのようなタンパクが働いて正常・異常を認識しているのだろうか? 謎は深く、興味は続く。
おわりに
筆者が、不思議なNMD現象から逃げ出したことの言い訳だが、1980-1990年代の初期は、NMDのような難しい問題を研究するのに「十分な技術が揃ってなかったから」、といえるだろう。腰を落ち着けて、ジックリ取り組める大学の研究室であれば、学生たちと一緒にやれたかもしれない。しかし、当時、筆者は、7年間という時限の官民共同プロジェクトの中にいて、早老症状を伴う遺伝病の原因解明の目的で創られた「エイジーン研究所」の責任者として、発見したばかりの5種類のRecQヘリカーゼに関して手一杯で、そちらの研究を急がねばならなかった。この時分、ウエルナー症候群についてよく講演に招ばれる機会があったが、「NMDは、ノーベル賞も取れそうな面白い課題です。是非、挑戦して下さい。必要なDNAや細胞など、供給します」と言って廻ったのだが、反応は無かったーーーあの当時、聴衆の皆さんも、「これは難しい」と思ったのかもしれない。
< 第一回 | 第二回 | 第三回 | 第四回 | 第五回 | 第六回 | 第七回 | 第八回 | 第九回 | 第十回 | 第十一回 | 第十二回 | 第十三回 | 第十四回 | >
References
1. Miura K, Watanabe K, Sugiura M, Shatkin AJ.
The 5′-terminal nucleotide sequences of the double-stranded RNA of human reovirus.
Proc Natl Acad Sci U S A. 1974 Oct;71(10):3979-3983.
PMID: 4530278
2. Furuichi Y.
"Methylation-coupled" transcription by virus-associated transcriptase of cytoplasmic polyhedrosis virus containing double-stranded RNA.
Nucleic Acids Res. 1974 Jun;1(6):809-822.
PMID: 10793759
3. Smith AE.
Modified nucleotides in messenger RNA?
Nature 1974 Aug;9 250(5466) 461.
PDF (237K)
4. Furuichi Y, Miura KI.
Identity of the 3′-terminal sequences in ten genome segments of silkworm cytoplasmic polyhedrosis virus.
Virology. 1973 Oct;55(2):418-425.
PMID: 4742779
5. Furuichi Y.
Discovery of m(7)G-cap in eukaryotic mRNAs.
Proc Jpn Acad Ser B Phys Biol Sci. 2015;91(8):394-409.
PMID: 26460318
6. Furuichi Y, Miura K.
A blocked structure at the 5′ terminus of mRNA from cytoplasmic polyhedrosis virus.
Nature. 1975 Jan 31;253(5490):374-375.
PMID: 163011
PDF (414K)
7. Furuichi Y, Morgan M, Muthukrishnan S, Shatkin AJ.
Reovirus messenger RNA contains a methylated, blocked 5′-terminal structure: m-7G(5′)ppp(5′)G-MpCp-.
Proc Natl Acad Sci U S A. 1975 Jan;72(1):362-366.
PMID: 1054511
8. Wei CM, Moss B.
Methylated nucleotides block 5'-terminus of vaccinia virus messenger RNA.
Proc Natl Acad Sci U S A. 1975 Jan;72(1):318-322.
PMID: 164018
9. Adams JM, Cory S.
Modified nucleosides and bizarre 5'-termini in mouse myeloma mRNA.
Nature. 1975 May 1;255(5503):28-33.
PMID: 1128665
PDF (1.6M)
10. J. Darnell H. Lodish D. Baltimore
Molecular Cell Biology
Scientific American Books, W. H. Freeman and Company. (1986)
11. James E. Darnell.
RNA: Life's Indispensable Molecule
Cold Spring Harbor Laboratory Press. ISBN: 978-1-936113-19-4.
CSH Press
Amazon.co.jp
12. Furuichi Y, Morgan M, Shatkin AJ, Jelinek W, Salditt-Georgieff M, Darnell JE.
Proc Natl Acad Sci U S A. (1975) 72(5):1904-1908.
PMID: 1057180
13. Furuichi Y, Muthukrishnan S, Tomasz J, Shatkin AJ.
J Biol Chem. (1976) 251(16):5043-5053.
PMID: 821947
14. Abraham G, Rhodes DP, Banerjee AK.
Cell. (1975) 5(1):51-58.
PMID: 165900
15. 古市 泰宏
蛋白質・核酸・酵素 (1977) 22(10), 1201-1204.
16. Sommer S, Salditt-Georgieff M, Bachenheimer S, Darnell JE, Furuichi Y, Morgan M, Shatkin AJ.
Nucleic Acids Res. 1976 Mar;3(3):749-765.
PMID: 1272797
17. Amiya K. Banerjee
Proc Natl Acad Sci U S A. (2012) 109(46):18629-18630.
18. Furuichi Y, Shatkin AJ, Stavnezer E, Bishop JM.
Nature. 1975 Oct 16;257(5527):618-620.
PMID: 170541 PDF
19. Gelinas RE, Roberts RJ.
Cell. 1977 Jul;11(3):533-544.
PMID: 884734
20. Thomas M, White RL, Davis RW.
Proc Natl Acad Sci U S A. 1976 Jul;73(7):2294-2298.
PMID: 781674
21. Berget SM, Moore C, Sharp PA.
Proc Natl Acad Sci U S A. 1977 Aug;74(8):3171-3175.
PMID: 269380
22. Krug RM, Morgan MA, Shatkin AJ.
J Virol. 1976 Oct;20(1):45-53
PMID: 1086370
23. Plotch SJ, Krug RM.
J Virol. 1977 Jan;21(1):24-34.
PMID: 833924
24. Bouloy M, Plotch SJ, Krug RM.
Proc Natl Acad Sci U S A. 1978 Oct;75(10):4886-90.
PMID: 283399
25. Furuichi Y, Shatkin AJ.
Proc Natl Acad Sci U S A. 1976 Oct;73(10):3448-52.
PMID: 185613
26. Bouloy M, Morgan MA, Shatkin AJ, Krug RM.
J Virol. 1979 Dec;32(3):895-904.
PMID: 513205
27. Furuichi Y.
Review:Caps on Eukaryotic mRNAs. In: eLS. John Wiley & Sons, Ltd: Chichester.
DOI: 10.1002/9780470015902.a0000891.pub3
28. Krug R.M. and Fodor E.
Webster-Textbook of Influenza
Wiley
Amazon
29. Urushibara T, Furuichi Y, Nishimura C, Miura K.
FEBS Lett. 1975 Jan 1;49(3):385-9.
PMID: 162886
30. Shatkin AJ.
Proc Natl Acad Sci U S A. 1974 Aug;71(8):3204-7.
PMID: 4528644
31. Hickey ED, Weber LA, Baglioni C.
Nature. 1976 May 6;261(5555):71-2.
PMID: 944859
32. Enigma Variations’ of mammalian messenger RNA. (News & Views)
Nature. 1975 May 1;255(5503):9
PDF
33. Muthukrishnan S, Both GW, Furuichi Y, Shatkin AJ.
Nature. 1975 May 1;255(5503):33-7.
PMID: 165427
34. Both GW, Banerjee AK, Shatkin AJ.
Proc Natl Acad Sci U S A. 1975 Mar;72(3):1189-93.
PMID: 165487
35. Both GW, Furuichi Y, Muthukrishnan S, Shatkin AJ.
Cell. 1975 Oct;6(2):185-95.
PMID: 1182800
36. Furuichi Y.
Proc Natl Acad Sci U S A. 1978 Mar;75(3):1086-90.
PMID: 349555
37. Furuichi Y, LaFiandra A, Shatkin AJ.
Nature. 1977 Mar 17;266(5599):235-9.
PMID: 557727
38. Filipowicz W, Furuichi Y, Sierra JM, Muthukrishnan S, Shatkin AJ, Ochoa S.
Proc Natl Acad Sci U S A. 1976 May;73(5):1559-63.
PMID: 1064023
39. Sonenberg N, Shatkin AJ.
Proc Natl Acad Sci U S A. 1977 Oct;74(10):4288-92.
PMID: 270673
40. Sonenberg N, Morgan MA, Merrick WC, Shatkin AJ.
Proc Natl Acad Sci U S A. 1978 Oct;75(10):4843-7.
PMID: 217002
41. Nahum Sonenberg
Biochem Cell Biol. 2008 Apr;86(2):178-83. doi: 10.1139/O08-034.
PMID: 18443631
42. Lazaris-Karatzas A, Montine K.S. Sonenberg N.
Nature. 1990 Jun 7;345(6275):544-7.
PMID: 2348862
43. Lazaris-Karatzas A. Sonenberg N.
Mol Cell Biol. 1992 Mar;12(3):1234-8.
PMID: 1532049
44. Kitamura N, Semler BL, Rothberg PG, Larsen GR, Adler CJ, Dorner AJ, Emini EA, Hanecak R, Lee JJ, van der Werf S, Anderson CW, Wimmer E.
Nature. 1981 Jun 18;291(5816):547-53.
PMID: 6264310
45. Nomoto A, Lee YF, Wimmer E.
Proc Natl Acad Sci U S A. 1976 Feb;73(2):375-80.
PMID: 174106
46. Lee YF, Nomoto A, Detjen BM, Wimmer E.
Proc Natl Acad Sci U S A. 1977 Jan;74(1):59-63.
PMID: 189316
47. Nomoto A, Kitamura N, Golini F, Wimmer E.
Proc Natl Acad Sci U S A. 1977 Dec;74(12):5345-9.
PMID: 202952
48. Nomoto A, Detjen B, Pozzatti R, Wimmer E.
Nature. 1977 Jul 21;268(5617):208-13.
PMID: 196204
49. Wimmer E.
Cell. 1982 Feb;28(2):199-201.
PMID: 7060125
50. Etchison D, Milburn SC, Edery I, Sonenberg N, Hershey JW.
J Biol Chem. 1982 Dec 25;257(24):14806-10.
PMID: 6294080
51. Kräusslich HG, Nicklin MJ, Toyoda H, Etchison D, Wimmer E.
J Virol. 1987 Sep;61(9):2711-8.
PMID: 3039165
52. Lee KA, Sonenberg N.
Proc Natl Acad Sci U S A. 1982 Jun;79(11):3447-51.
PMID: 6954488
53. Sonenberg N, Pelletier J.
Bioessays. 1989 Nov;11(5):128-32.
PMID: 2556117
54. Marilyn Kozak and Aaron Shatkin
J. Biol. Chem. 1976 Jul.; 251(19):4259-4266.
PMID: 932032
55. Marilyn Kozak and Aaron Shatkin
J. Biol. Chem. 1977 Oct.; 252(19):6895-6908.
PMID: 893449
56. Marilyn Kozak
Nature. 1977 Sep; 269: 390-394.
PMID: 909586
57. Marilyn Kozak
Annu. Rev. Cell Biol. 1992; 8:197-225. Review
PMID: 1335743
58. Marilyn Kozak
Mol. Cell Biol. 2001 Mar;21(6): 1899-1907. MiniReview
PMID: 11238926
59. Robert Schneider
Mol. Cell Biol. 2001 Dec;21(23): 8238-8246. Letter to Editor
PMID: 11710333
60. Marilyn Kozak
Mol. Cell Biol. 2001 Dec;21(23): 8246-8256. Author’s Reply
61. Marilyn Kozak
Nucleic Acids Res. 2001 Dec 15; 29(24):5226-5232.
PMID: 11812856
62. Marilyn Kozak
Gene. 2007 Nov 15; 403(1-2): 194-203.
PMID: 17888589
63. 古市泰宏 Marilyn Kozak
蛋白質核酸酵素 1977, 22(3), p236-240.
64. KozakM and Nathans D.
Bacteriol Rev. 1972 Mar;36(1):109-34. Review.
PMID: 4555183
65. Saiki RK, Scharf S, Faloona F, Mullis KB, Horn GT, Erlich HA, Arnheim N.
Science. 1985 Dec 20;230(4732):1350-1354.
PMID: 2999980
66. Saiki RK, Bugawan TL, Horn GT, Mullis KB, Erlich HA.
Nature. 1986 Nov 13-19;324(6093):163-6.
PMID: 3785382
67. Mullis K, Faloona F, Scharf S, Saiki R, Horn G, Erlich H.
Cold Spring Harb Symp Quant Biol. 1986;51 Pt 1:263-73.
PMID: 3472723
68. Mullis KB, Faloona FA.
Methods Enzymol. 1987;155:335-50.
PMID: 3431465
69. Gelfand DH and White TJ.
PCR Protocols: A Guide to Methods and Applications (Edited by Innis MA, Gelfand DH, Sninsky JJ, White TJ, Academic Press, San Diego), 1990;p129-141.
Amazon
70. Nuss DL, Furuichi Y, Koch G, Shatkin AJ.
Cell 1975;6:21-27.
PMID: 1164732
71. Nuss DL, Furuichi Y.
J Biol Chem. 1977 May 10;252(9):2815-21.
PMID: 16003
72. Yamakawa M, Furuichi Y, Nakashima K, LaFiandra AJ, Shatkin AJ.
J Biol Chem. 1981 Jun 25;256(12):6507-14.
PMID: 7240222
73. Ogino T, Yadav SP, Banerjee AK.
Proc Natl Acad Sci U S A. 2010 Feb 23;107(8):3463-8.
PMID: 20142503
74. Abraham G, Rhodes DP, Banerjee AK.
Nature. 1975 May 1;255(5503):37-40.
PMID: 165428
75. Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Yazaki Y, Goto K, Masaki T.
Nature. 1988 Mar 31;332(6163):411-5.
PMID: 2451132
76. Arai H, Hori S, Aramori I, Ohkubo H, Nakanishi S.
Nature. 1990 Dec 20-27;348(6303):730-2.
PMID: 2175396
77. Sakurai T, Yanagisawa M, Takuwa Y, Miyazaki H, Kimura S, Goto K, Masaki T.
Nature. 1990 Dec 20-27;348(6303):732-5.
PMID: 2175397
78. Adachi M, Yang YY, Furuichi Y, Miyamoto C.
Biochem Biophys Res Commun. 1991 Nov 14;180(3):1265-72.
PMID: 1719979
79. Breu V, Hashido K, Broger C, Miyamoto C, Furuichi Y, Hayes A, Kalina B, Löffler BM, Ramuz H, Clozel M.
Eur J Biochem. 1995 Jul 1;231(1):266-70.
PMID: 7628480
80. Summers MD, Anderson DL.
J Virol. 1972 Apr;9(4):710-3.
PMID: 5021310
81. 宮本力、古市泰宏
蛋白質・核酸・酵素、35、2598-612 (1990)
PMID: 2176306
82. Satoh M, Miyamoto C, Terashima H, Tachibana Y, Wada K, Watanabe T, Hayes AE, Gentz R, Furuichi Y.
Eur J Biochem. 1997 Nov 1;249(3):803-11.
PMID: 9395330
83. 宮本力
BIO medica 5, 1277-1281 (1990)
84. Zaug AJ, Cech TR.
Cell. 1980 Feb;19(2):331-38.
PMID: 7357611
85. Grabowski PJ, Zaug AJ, Cech TR.
Cell. 1981 Feb;23(2):467-76.
PMID: 6162571
86. Wild MA, Gall JG.
Cell. 1979 Mar;16(3):565-73.
PMID: 455443
87. Cech TR, Zaug AJ, Grabowski PJ.
Cell. 1981 Dec;27(3 Pt 2):487-96.
PMID: 6101203
88. Peltz SW, Brown AH, Jacobson A.
Genes Dev. 1993 Sep; 7(9):1737-54.
PMID: 8370523
89. Karousis ED, Nasif S, Mühlemann O.
Wiley Interdiscip Rev RNA. 2016 Sep;7(5):661-82.
PMID: 27173476
90. Chang JC, Temple GF, Trecartin RF, Kan YW.
Nature. 1979 Oct 18;281(5732):602-3.
PMID: 492326
91. Maquat LE, Kinniburgh AJ, Rachmilewitz EA, Ross J.
Cell. 1981 Dec;27(3 Pt 2):543-53.
PMID: 6101206
92. Matsumoto T, Shimamoto A, Goto M, Furuichi Y.
Nat Genet. 1997 Aug;16(4):335-6.
PMID: 9241267
93. Yamabe Y, Sugimoto M, Satoh M, Suzuki N, Sugawara M, Goto M, Furuichi Y.
Biochem Biophys Res Commun. 1997 Jul 9;236(1):151-4.
PMID: 9223443
94. Thermann R, Neu-Yilik G, Deters A, Frede U, Wehr K, Hagemeier C, Hentze MW and Kulozik AE.
EMBO J. 1998 Jun 15;17(12):3484-94.
PMID: 9628884
95. 山下暁朗
実験医学、30、1471-80 (2012).
96. Kurosaki T, Maquat LE.
J Cell Sci. 2016 Feb 1;129(3):461-7.
PMID: 26787741



