先日の新潟での日本RNA学会年会の特別講演で、古市泰宏先生が、「研究者には二つのタイプがある。それは研究テーマを変える人と変えない人」、とおっしゃっていたが、私は後者に当たるだろう。その実情は、取りたてて褒められるようなことではなく、次から次からへと面白い問題があり、単に研究テーマを変える暇がなかっただけである。年会の会場で、片岡直行さんと北畠真さんから、「スプライシング発見40周年に際し、会報にぜひ何か寄稿してください」、と依頼された。満足していただける文章が書けるか、あまり自信はない。しかし、ちょいと数えてみると、今年はスプライシング研究に関わってから35年にもなり、スプライシング研究の歴史と、ほぼ重なっているではないか。運良くアメリカでスプライシング研究の中心に長く身を置くことができたこともあり、研究の最前線を実体験できた。これを機会に自分の研究経歴を気軽に振り返ってみるのもいいかと思って、引き受けることにした。研究者をめざす若い人に何かを伝える〜といった上から目線でなく、論文を熟読しても決してわからない、研究現場の舞台裏を、まあ面白おかしく楽しんでもらえれば十分かと思う。
■分子生物学に魅せられたが、音楽・スポーツに熱中した
分子生物学に魅せられたきっかけとなったのは、中学1年生の時に学校の図書室で、たまたま手に取った『生命の暗号をとく』(1970年発行)という本だったことは確かである。当時の中学校・理科の授業では、分子生物学の内容はなく、この本によって始めてDNA、RNA、蛋白質と生命の関わり、いわゆるセントラル・ドグマを知ったのである。複雑を極める生命現象の元に、こんなにも単純な原理があったのかと驚き、すっかり魅了されてしまった。直感で一生関わってもいい学問だと思った。
ところが、中学、高校時代に夢中になっていたのは、クラブ活動の器械体操と趣味の音楽であった。クラシック音楽ではベートーヴェンに完全にイカれてしまった。あの超まじめで、尋常ではないひつこさ、ねちっこさ! 音楽好きの方は知っての通り、ベートーヴェンの音楽は、動機と呼ばれる数小節のテーマが全曲を支配する。これでもか、これでもかと迫ってくる。この男は一つ道を間違えれば、ストーカーになっていたかもしれない。しかし、彼のやり方は、大いに研究に役立つ。単純なテーマで全体を綿密に構成された論文はアピール力があり美しい。加えて、どんなに逆境に追い込まれても、戦い続ける不屈の精神! プロの研究者には必須の能力である。後々、研究ではいろいろと悪戦苦闘するが、彼の音楽から伝わる生き様は、いつも勇気づけてくれた。あとイギリスのプログレッシブ・ロック(とりわけELP)の壮大な音楽のストーリー性にもハマった。LPレコードやFM放送から録音したカセットテープを聴きまくった。中、高校生の間は、好きなことばかりやっていて、つまらない学校での勉強とは無縁であったと言っても過言ではない。
そのようなていたらく、案の定、二浪する羽目になり、しかも運悪く、二浪目には受験制度の世紀の大改革があり、共通一次試験元年に突入してしまった! 自業自得とはいえ、最悪のタイミングだ。それまでは、国立大学は一期校、二期校と、二度のチャンスがあったわけであるが、一度(一校)しか受験できなくなってしまった(後にこの制度は変わったが・・・)。さすがに三浪はしたくなかったので、予備校での試験で「A(合格確実)」と太鼓判をもらった大学しか選択の余地がなかった。赤本と呼ばれていた各大学の入試問題集を見て、埼玉大学が気に入った。地方の国立旧二期校にしては珍しく、生物系学科が二つ(生化学科と生体制御学科)で計8講座もある。生体制御学という風変わりな名前にも惚れた。赤本で器械体操部があることも、しっかりチェックしていた。「勉強しろ」、とは一切言わず、「何でも明は好きなことをしたらいいわ〜」と言い続けていた寛大かつ楽天的な両親に大感謝しなければなるまい。二浪目はさすがに生まれて初めて真剣に受験勉強した。その甲斐あって無事、埼玉大学理学部・生体制御学科に合格することができた。
埼玉大学と言えば、2015年にノーベル物理学賞を受賞された梶田隆章先生の母校ということで、ちょいと話題になった。年代を調べてみると、なんと私が生体制御学科にいたときに、畏れ多くも梶田先生は物理学科にいらっしゃったのだ。先生も私も大学学部の勉強はそっちのけで、先生は弓道場で弓道に、私は体育館で体操に熱中し、青春の汗を流していたと知り、親密感を感じた。もちろん当時は、お互い知るよしもなかったが・・・。そういえば、我らが英雄、山中伸弥先生(2012年ノーベル生理学・医学賞)は、中学から柔道とラグビーに打ち込み何回も骨折、大村智先生(2015年ノーベル生理学・医学賞)は、クロスカントリースキーに熱中し国体選手にも選ばれた、というから大先生方は半端やない。何をやるにも体が資本、健康第一であるから、もし運動好きならば、若い時にしかできない激しいスポーツに本気で打ち込むのはいいことだと思う。勉強は、若くなくてもできるのだ。
さて、無事合格した私は北浦和に下宿も決まり、暇でやることがない。居ても立ってもいられなくなり、入学式より前に体操部が練習していた体育館に行き、即刻、体操部に入部した。同好会のようなヤワなサークルではなく、マジ体育会系だったので、大学生活は部活中心となり、四年間、しっかりと勤めあげた。ちなみに私の体操は下手の横好きであり、試合での成績も大したことはなく、三年の時には二つの予選を勝ち抜き、全日本インカレに二部校として参加したが、これはひとえに体操が上手かった教育学部・体育学専攻の先輩、後輩のお陰である。しかし、自分でやる技を考えて演技を構成し、自分で表現することは面白かった。体操の世界では、世界で最初に新しい技を発表したら、その技にその人の名前が付くのである。独創性と美的センスが問われるサイエンスの世界と共通したものがある。
■mRNA前駆体スプライシングに一目惚れ
同級生と学内の喫茶店で話していた時、どんな学問が面白いかという雑談をしていたのを覚えている。結論は、RNAか脳(記憶・意識の実体)の研究が面白いに違いないとなった。さてどちらを選ぶか。脳の問題は生物学の究極であり、すごく魅力はあったが、おそらく自分が生きている間に記憶や意識の問題が科学的に解明できるとは思えなかった。
大学時代は、とにかく体操部中心の生活をしていたので、必要な講義や実習は出席するだけの平凡な学生だった。しかし、面白そうな講演会にはちょくちょく聴講しに行った。東京は、そういった一般公開の講演会が多く、北浦和駅からは電車ですぐに行けて便利だった。その一つが、故渡辺格先生の講演会だった。講演の内容はよく覚えていないが、最後のスライドでRNAが天上に光輝く図を見せられて、「今後はRNAに大きな秘密がある」、と威厳をもって仰せられたのが、とても印象に残っている。何となく背中を押されるようにRNAの方を選んだ。
その後、U1 snRNAがスプライス部位と相補的結合していると提唱したJoan Steitzの仮説(図1)を見たことがきっかけでmRNA前駆体スプライシングにのめり込んでいった。もちろんU1 snRNAが3′スプライス部位に対合するところは誤りであったが、合理的かつエレガントな予想である。セントラル・ドグマにおいて、mRNAの3塩基とtRNAのアンチコドンが塩基対合をするというクライマックス的現象が、スプライシングにおいても存在しているのを見て、私は単純に美しいなあ〜と感動した。この一目惚れ以来、幸か不幸か、スプライシング道から浮気をしたことがなく、スプライシング研究をし続け、今に至っているわけである。

図1 Joan Steizが1980年に提唱した、U1 snRNAが両スプライス部位に塩基対合するモデル(Lerner et al. 1980)。U1 snRNAと5′スプライス部位の対合は、6年後に正しいことが証明された(Zhuang & Weiner 1986)。
さて、研究をやるには大学院に進学しないといけないが、ある時、新聞記事を見たことで、筑波大学の大島靖美先生(当時、筑波大学生物科学系の助教授)がスプライシングの研究をされていることを知った。その新聞記事にはSteitz仮説の変形で、U1 snRNA がイントロンではなくエクソンに対合している図が描かれていた(実際は誤った仮説だった)。思いは一筋で、大島先生に弟子入りしようと連絡すると、所属されていた生物科学系ではなく、講義を担当されていた筑波大学大学院・医科学研究科(修士課程)の受験を勧められ、首尾よく入学することができた。学部の入試は大変だったが、大学院の入試には、社会や古文といった嫌いな科目もなく、英語も辞書の持ち込みあり、という寛大さのお陰だ。1983年の春であった。
■筑波大学大学院から始めた研究
学部時代は、ほとんど実験をやったことがなく、大学院から、初めて分子生物学や生化学の基本となる実験を、大島先生や研究室の先輩から習った。その当時は、まだ43歳と若かった先生は、まだ実験もされていて、当初は文字通り手取り足取り教わった。手間のかかる大学院生だったに違いない。私の実験研究者としての基礎ができたのは、ひとえに大島先生のお陰であり、感謝している。大島先生は、一つの実験をやる度に、詳細な記録を日付付きで26穴のレポート用紙に書かれ、実験が終わればルーズリーフ・バインダーに綴じ込んでいらっしゃった。材料を最初に書き、手順を書き、結果のデータを横にはり(記述は片面に書くから裏側にデータを貼れる)、最後には必ず結論を箇条書きで書かれていた。この流儀を、私がそのまま習ったのは本当によかった。指導者からやった実験のことを聞かれたら、直ちにノートを見て、その内容を事細かく説明できた。同僚や後輩のためにプロトコールを作るのも、この詳細な実験ノートがあるとお手の物だ。ちなみに、今書いているエッセーを日付入りで正確に書けるのも、この実験ノートのお陰である。アメリカに留学してからわかったことだが、実験に関する基礎訓練は、日本人の方がしっかりできている。日本の研究室の徒弟制度的な、先生や先輩から受ける徹底した訓練が効を奏している。
さて、当時のスプライシング研究の状況であるが、1977年にmRNA前駆体にイントロンが存在し、それがスプライシングによって取り除かれてmRNAが作られることがわかり、そのスプライシング機構や関与する因子について研究が本格的に始まり、ホットな研究領域となっていた。スプライシング発見に至る初期の状況は、古市先生のエッセー『走馬灯の逆廻し(2)、(3)』に詳しいので、ぜひ読んでほしい。新しい結果が続々と一流誌に発表されていた。当時月刊だったCell誌には、毎月必ず二、三報のスプライシング関連の論文が出ていた。その頃、日本で本格的にmRNA前駆体スプライシング研究をされていたのは、大島靖美研究室(筑波大学生物学系)と、志村令郎研究室(京都大学理学部)の二ヶ所だけであった。先生同士はよきライバルであったかもしれないけれど、分子生物学会年会では、常に同じセッションで発表してきたので、研究室の若い衆同士はいろいろと交友関係ができて楽しかった。今でも、志村研出身の皆さまとは親しい友人ばかりである。そうそう、まったく偶然であるが、分子生物学会年会で大島研と志村研で口頭発表の演題がまったく同文だったことがある。発表するセッションの日程が最終日の遅い時間だったりした時は、聴衆をよく見ると、大島研と志村研の連中しかいなかったこともある。スプライシングの研究は、日本ではあまり盛り上がっていなかったなぁ〜。
研究室に入って、最初に取り組んだのは、スプライス部位を認識する因子を探索するというテーマであった。スプライス部位配列をもつ32P標識されたRNAをin vitro転写で合成し、HeLa細胞核抽出液をDEAE-セファロース・クロマトグラフィーで部分精製した画分と混ぜ合わせて、フィルター結合解析法で、特異的に結合する画分を見いだすという手法である(図2)。予想通りU1 snRNPを含む画分には、5′スプライス部位RNAが結合したが、snRNPが存在しないフロースルー画分に、3′スプライス部位RNAとブランチ部位RNAに対する結合活性があった。さらに、フロースルー画分には、U1 snRNPと5′スプライス部位RNA間の結合を著しく促進する活性が存在することを見いだした。U1とU2 snRNPがスプライシングに関与することが知られていただけの当時、私たちの仮説モデルを見てもらえば(図3)、3′BF = U2AF、BBF = SF1、SF = SR蛋白質に対応し、まんざらトンチンカンな予想ではない。この研究結果が、私の筆頭著者論文のデビューとなった(Mayeda et al. 1986)。もちろん、予想した因子は部分精製品であり、完全精製・同定をめざしたかったが、実現しなかった。おそらくフロースルー画分に3′スプライス部位RNAに結合するU2AFやブランチ部位に結合するSF1といった蛋白質因子が存在していたに違いない。
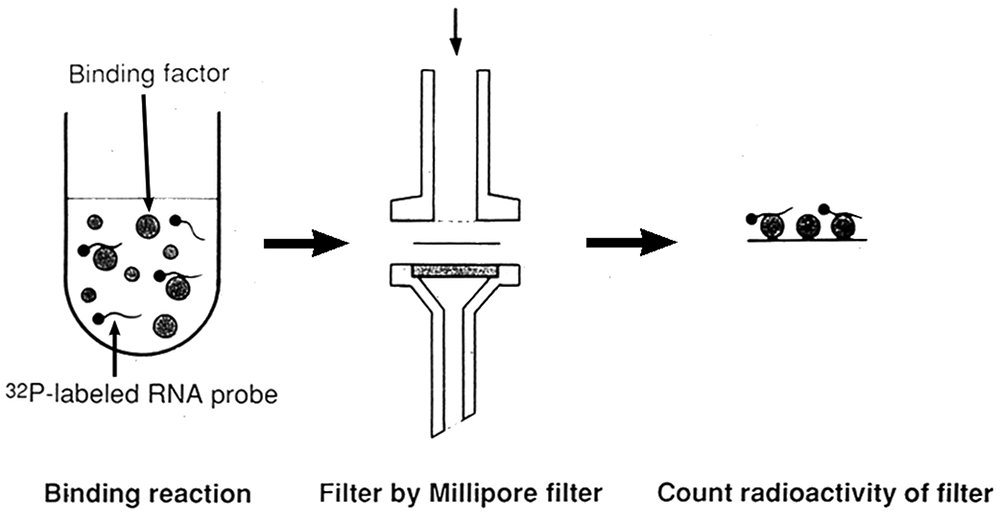
図2 フィルター結合解析法(Filter binding assay)。蛋白質因子が32P放射性標識RNAに結合すると、濾過されずにフィルター上に残るため、フィルターの放射能測定により結合活性を評価できる。
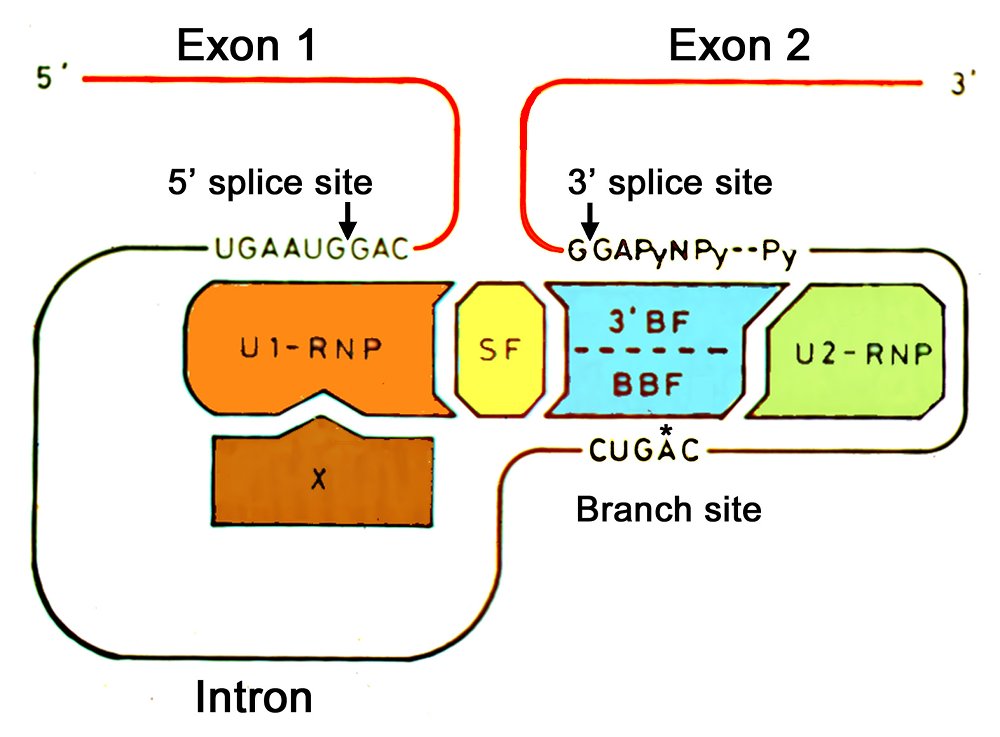
図3 1984年当時に、大島研で提唱したスプライス部位認識のモデル。フィルター結合解析法によって、存在が予想された因子が3′BF、BBF、SFである(Mayeda et al. 1986)。
スプライシング機構や因子の研究は、遺伝学が使える酵母を使った実験が大きく貢献し、その情報を利用しつつ、ヒトのスプライシング機構の研究は、in vitroスプライシング系が使えるようになって1980年代後半に大きく進展した。最初ではなかったが、実用的なin vitroスプライシング系を開発したのがハーバード大学のManiatis研であった。当時のポスドクRobin Reed、Michel Green、大学院生のAdrian Krainerらが実験をしていた。大島研究室でもぜひin vitroスプライシング系を取り入れて研究しようという機運になったが、その材料であるHeLa細胞の核抽出液を作るのに苦労した。引用された論文(Dignam et al. 1983)に方法が書いてあるのだが、その通りにやってもなかなかスプライシング活性のある核抽出液を調製することができなかった。最初の4回は、まったくスプライシング活性のない核抽出液ができ、5回目には、なぜかスプライシングの第一段階だけがいく妙な抽出液ができた。これはスプライシングの第二段階に関わる因子が欠けた抽出液と思われ興味深いが、後にも先にもこのような活性をもつ抽出液が取れたためしがない。6回目にやっとスプライシング活性のある核抽出液が取れた。論文のMaterials and Methodsに記載されている情報だけでは不十分で、書かれていないノウハウやコツが必要だと痛感した。渡米してからの後日談であるが、「論文通りやってもin vitroスプライシングがうまくいかないから教えてくれ」、と言うリクエストが世界中から沢山きて、誰でも読めばできるような懇切丁寧なプロトコールを作って送ったら、すごく感謝された。ちなみに、これは今では出版されている(Mayeda & Krainer 2012)。
さてスプライシング系ができて最初に挑戦したこととは、フィルター結合解析法で予想できた活性のある画分を含め、大胆にもスプライシング活性の再構成することであった(図4)。今でこそスプライシングはスプライソソームという巨大な複合体で遂行される複雑極まりない反応系であり、5つのsnRNPと170種を超える蛋白質因子が必須であるという事実がわかっているが(Will & Luhrmann 2011)、当時はU1、U2 snRNPが関わっているぐらいのことしか知られていなかったから、このような竹槍でB29爆撃機を突き落とすような無謀な実験をやっていたのである。当然のことながら、期待したような結果はなかなか得られず、大学院生として、こんなことをやっていたら論文が出ない、しからば学位もままならない、と焦ってきた。
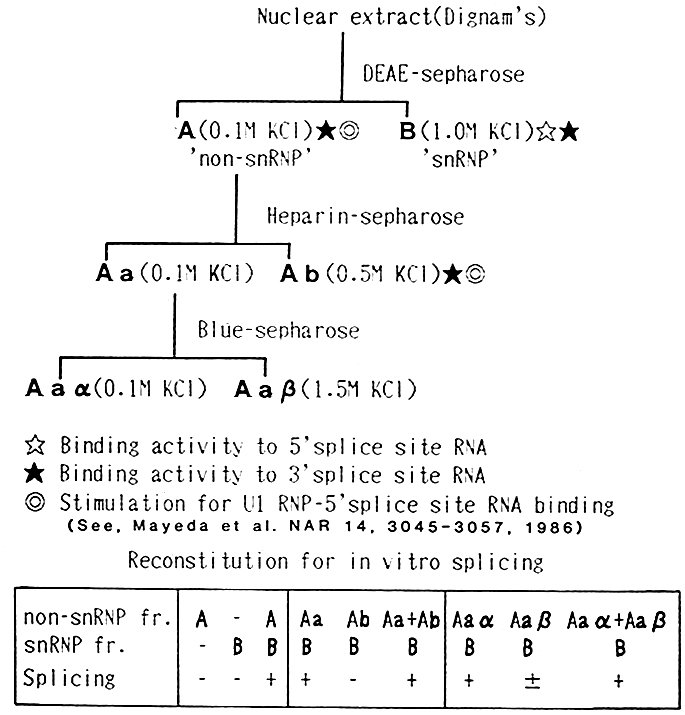
図4 スプライシング活性のあるHeLa細胞核抽出液を部分精製し、その画分のスプライス部位結合活性を調べ、スプライシング活性の再構成を試みた。
泣く泣く研究テーマを変えることにしたが、興味があったのがスプライス部位の選択であった。当時、選択的スプライシングという現象があることがわかり始めてきて、この問題は潜在的に重要ではないかと思った(これが大当たりで後にAdrian Krainerとの出会いにつながる)。本当にやりたかったのは、スプライシング部位の選択に関わる因子を精製・同定することであったが、これは時間がかかって学位に間に合わない。そこで、手っ取り早くin vitroスプライシングで変えられる条件である塩濃度の影響を調べてみることにした。mRNA前駆体としては、Maniatis研で標準基質として使われていたβ-グロビンのイントロン内に種々の5′スプライス部位配列を挿入したものをモデルとして使い、(本来の)遠位5′スプライス部位と(挿入した)近位5′スプライス部位の選択活性を調べられるようにした。実験をやってみると、塩濃度(KClとMgCl2)が上がるにつれ、遠位5′スプライス部位から近位5′スプライス部位の利用にシフトすることがわかった。またスプライシング活性は、挿入した近位5′スプライス部位の配列に依存するが、不思議なことに保存性の高いコンセンサス配列が必ずしもよく使われないことがわかった。実は、スプライシング活性に塩濃度が関与することは以前にも報告されていたので、この研究は新規性、独創性に欠け、まったく自信がなかった。しかし、結果がきれいだったためか、この論文は苦労せずに受理されたことを覚えている(Mayeda & Ohshima 1988)。これで首尾良く学位(筑波大学・医学博士)を取得することができたが、自分自身は、上記に述べたように、スプライシング因子の同定という大志を抱いていた経緯もあり、こんなチョロい業績で博士号を取っていいものかと大いに不満であった。先輩に話したら、「心配するな、医学部なんて、理科の実験程度で医学博士を取るんやで〜」と言われたが、まったく励ましになっていなかった。
In vitroスプライシング系を使いこなせるようになると、どんどんアイデアを試してみることができ楽しかった。二つの研究課題で成果が得ることができた。一つは、イントロンの配列だけでイントロンが認識されてスプライシングされるだろうか、という問題だった。β-グロビン・エクソン配列(cDNA)の種々の場所にイントロン断片をぶち込んでin vitroスプライシングの効率を見るという実験で、β-グロビンのイントロンのような強いスプライス部位を持つイントロン断片は、それ自体と5′スプライス部位の認識に必要な5′側エクソン3塩基で必要十分で、イントロンの位置や周りのエクソン配列は、基本的なスプライシングには必須でない、という結論が得られた(図5)(Mayeda & Ohshima 1990)。あとβ-グロビンのエクソン配列は大変安定で、アンチセンス配列にすると著しく不安定になるという意外な発見もあった。

図5 β-グロビンのエクソン配列のいろいろな場所に第1イントロンを挿入したmRNA前駆体基質を用いた、in vitroスプライシング解析。イントロン自体と5′側エクソンの3塩基(MI)だけで、スプライシングに必要十分だということが示された(Mayeda & Ohshima 1990)。
もう一つの成果は、アンチセンスRNAを用いたスプライシング阻害実験で、12塩基長のアンチセンス2′-O-Me RNA断片の添加だけで、β-グロビンの5′スプライス部位が完全に阻害され、上流の(サラセミア病での5′スプライス部位の突然変異で代わりに使われる)潜在的5′スプライス部位が使われるようになることを0%から100%への完全なスイッチとして美しく示せた(図6)。その当時、snRNAに対するアンチセンスRNAを用いたスプライシング阻害実験は報告されていたが、mRNA前駆体基質に対するアンチセンスRNAによるスプライシング阻害は、(私の知る限り)世界で最初期だったと自負している(Mayeda et al. 1990)。論文が日本生化学会誌のJ. Biochem.であったのはわけがある。最初Nucleic Acids Res.誌に投稿したが、運悪く、査読者の1人が上記のsnRNAに対するアンチセンスRNA実験を最初に報告したAngus Lamondだったのだ! このようなmRNA前駆体に対するアンチセンスRNAによるスプライシング阻害が、後々、細胞で、動物で、そしてヒトでも有効に働くことが実証され、遂には患者の薬にまで発展するとは・・・、当時は夢のまた夢の話に過ぎなかった(この話は、後日、解説しよう)。
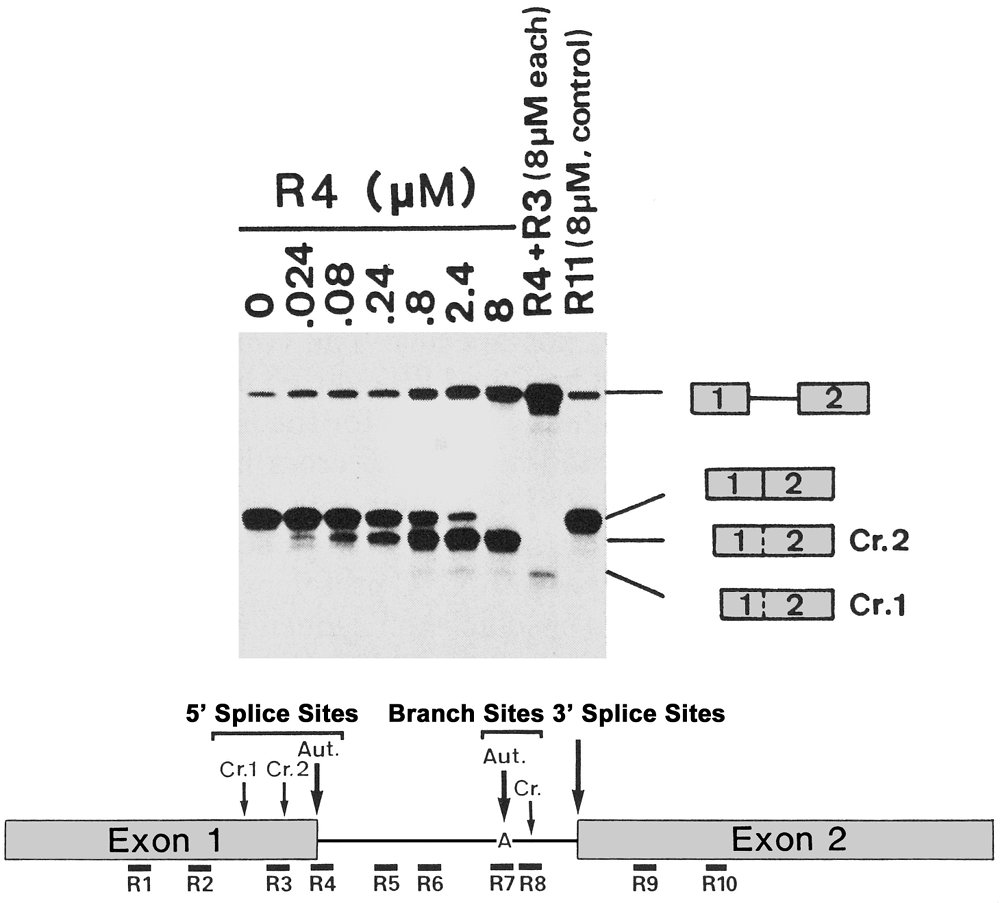
図6 β-グロビンのmRNA前駆体の種々の場所に相補的結合するアンチセンス2′-O-Me RNA(12塩基長)を加えin vitroスプライシングを行った。サラセミア病での5′スプライス部位の変異(GU → AU)と全く同様の効果が8 μMのアンチセンス2′-O-Me RNA (R4)添加だけで再現できた(Mayeda et al. 1990)。アンチセンスRNAを用いたスプライシング阻害は、Ryszard Kole(当時、ノース・キャロライナ大学)が、1992年ごろから精力的に行い、in vitroから細胞での実験に発展させた。
PCRがない時代である。容易に想像できるだろうが、上記のような実験をやるためには制限酵素部位の探索と利用が必須で、いろいろと悪戦苦闘して切ったり貼ったりのサブクローニングを嫌と言うほどやらないといけない。しかし目的がはっきりしていたので、そういった苦労も楽しみながらやれた。また核酸合成が大変高価だった当時に、上記の実験を可能にしたのは、大島靖美先生のご紹介でDNAと修飾RNAを合成していただいた田中秀明先生(当時、化学技術研究所)と大塚栄子先生(当時、北海道大学薬学部)のご協力のお陰である。
■Adrian Krainerに誘われコールドスプリングハーバー研究所へ留学
当時のスプライシング研究はアメリカが中心であり、とりわけヒト(哺乳動物)のスプライシングではエール大学のSteitz研(Doug Black, Benoit Chabot)、MITのSharp研(Rick Padgett, Paula Grabowski, Maria Konarska)、ハーバード大学のManiatis研(Mike Green, Robin Reed, Adrian Krainer)が世界をリードしていた。ヨーローパではKeller研(Angela Krämer)がライバルとして初期の頃から活躍していた。上記で括弧内に書いた当時の大学院生やポスドクは、皆さん第一線の教授となって活躍されている。
彼らの新しい結果が、次々と超一流誌に発表され続けるのを見て、いくら大志を抱いて日本で孤軍奮闘しても、絶対にかなわないと感じていた。PubMedのような便利な文献検索サイトがない時代、大したことがない研究成果を二流誌に発表しても、彼らの眼中になく、蚊帳の外に置かれている空しさを感じていた(実際はそうではなかったことが後日わかったのだが!)。とにかく学位を取るまでは臥薪嘗胆、学位を取ったらポスドクとしてアメリカに留学したいと、ずっと心に抱いていた。
チャンスは予想できるものではない。だから、後先のことを考えすぎない方が、チャンスに巡り合いやすいのも事実である。そんな話をしてみたい。上記のβ-グロビン・イントロンの配列だけでイントロンとして認識されてスプライシングが起こるという研究成果を、恩師の大島先生はコールドスプリングハーバー研究所で発表させてくれたのである(図7)。当時、スプライシング研究の最前線は、この研究所で毎年行われていたRNA Processing Meeting(現在のAnnual Meeting of the RNA Societyの前身である)であり、世界中から第一線の研究者が一堂に会し、未発表データを開陳し、熱く議論する場となっていた。ポスター発表の当日(忘れもしない1989年5月19日)、ポスターの前に立っていたら、190 cmはあろうかと思われる大男がやって来るではないか。近づいてきて名札の名前「Adrian R. Krainer」が目に入って、あのKrainerは、へえ〜この人なんやぁ〜とびっくり仰天した。実用的なin vitroスプライシングを開発し、投縄状イントロンを発見し、U1、U2 snRNPを含む基本的な因子の存在を生化学的な精製で示した1984年から1985年にかけてのCell論文の3連発で、スプライシング業界の度肝を抜いていたManiatis研の著者だったからだ(Krainer et al. 1984; Ruskin et al. 1984; Krainer & Maniatis 1985)。極東の名も知れぬ大学の無名の若造が、誠に恥ずかしい限りのささいな研究成果を前にもじもじしていると、来ていきなり、「I know your studies in Ohshima Lab very well.」と言うではないか! 驚くべきことに、彼は私の大学院時代の論文は、すべて読んでいた。大した結果じゃないなぁ〜と思っていても、たとえ二流誌、三流誌であっても、ちゃんと論文にしておいたのはよかったぁ、と痛感した。ポスター内容にも興味津々で、とにかく慣れぬ英語で一生懸命説明した。

図7 1989年のRNA Processing Meetingにポスター発表した要旨。
研究の話がひとしきり終わると、自分の話をしてきた。「ハーバード大学で学位を取って、コールドスプリングハーバー研究所のRich Roberts研でポスドクだけど、3年目でNIH(R01)グラントを取得できたから独立できることになった。最初のポスドクとしてぜひ来てくれませんか」、と言うのだ! Richはご存知のようにイントロンを発見した一人で、1993年にノーベル生理学・医学賞受賞した。夕食も一緒に食べないかと誘われ、隣町のハンチントンの中華料理店に連れて行ってくれた。研究の話をしていくと、Adrianがなぜ私を雇ってくれたか、なるほどと合点が行った。彼は、「6年前よりスプライシング因子の生化学的精製に取り組んでいて、つい最近、SF2という33 kDa蛋白質の同定に成功したんだ」、と告白した。「その因子は、スプライシングに必須であるだけでなく、5′スプライス部位の選択に影響を与えて、すこぶる面白いんだ」、と興奮気味に話してくる。私の論文を読んでいた彼は、「Akilaは5′スプライス部位の選択に興味を持っているだろう、生化学的精製も取り組んでいただろう。だから、ぜひ一緒に研究をやりたい」、と情熱的に説き伏せてきた。私の大学院時代と言えば、研究発表の場は日本生化学会大会と日本分子生物学会年会であり、一度も国際的なミーティングで発表していない。先進的な研究には足下にも及ばない、と思いながらも、結果を論文にまとめていたからこそ、こんなラッキーなことが起こったのだ!
実験科学者にとって一番ワクワクして楽しいのは、実験をして発見につながる素晴らしいデータが出た時だろう。再現性を確認したり、必要なコントロールを含めて追試したり、論文図のためにより良いデータを取り直したり、さんざん実験をやりまくって、いざ研究成果をまとめる段階では、はっきり言って興ざめしている。論文にまとめるという仕事は、面倒臭くてあまり面白いものではない。やっと論文を投稿したと思ったら、今度は査読者からこき下ろされ、さんざん文句を言われて、また実験をやり直さなければならない。時間をかけて、しっかり実験をやり直しても、最終結果は掲載拒否(Reject)ということも、レベルの高い雑誌であれば珍しいことではない。こういう仕打ちを受ければ、書き直して違う雑誌に再投稿だ。その繰り返しで、5つ、6つの雑誌を経ることもちょくちょくである。最初の投稿から1、2年たってからようやく日の目を見ることだってある。しかし、このつまらない仕事を、忍耐強く、かつ楽天的にやりこなしていくことが、プロの研究者としては何よりも大事なのである。そうそう、最初に話した七転び八起き、不屈の精神だ! ショックを受けて、立ち直りが難しい人はいるが、それは無理もない。ただ、そういう人は研究者には向いていない。
このミーティングから帰国後、間もなくしてAdrianから正式のポスドク招聘の手紙が航空便できた(電子メールがない時代である)。その手紙には、コールドスプリングハーバー研究所の研究環境が、いかに素晴らしいかが具体的に書いてあった。その一節を引用してみよう。
「The Cell Culture Facility grows the HeLa cells for us, upon request. The DNA Synthesis Facility makes our oligonucleotides. The Protein Chemistry Facility does aminoacid analysis and peptide synthesis and sequencing. The Animal Facility takes care of rabbits and mice, and carries out immunizations and bleeds. The Monoclonal Antibody Facility prepares hybridomas and ascites fluid. There are also electron microscopy and Two-demiensional Gel Electrophoresis facilities. All of these make it possible for small research groups to get a lot of work done. Finally, because of all the meetings, courses, and seminars that take place at Cold Spring Harbor, scientists from all fields of biology are constantly visiting the lab, and provide a constant flow of information and ideas, and make this a very exciting place to be.」
実際にコールドスプリングハーバー研究所に行って、これらすべてに嘘偽りがないことがわかった!
まさに渡りに船、すぐにでも飛んで行きたいところだったが、当時私は九州大学理学部に教授として栄転された大島先生の元でお世話になっており、日本学術振興会の特別研究員制度の初年度で採用された学振PDという身分であった。上記二つの成果(図5、6参照)を、二報の論文にまとめないといけなかった。卒業研究の学生さんの指導もしていた。そういう状況があったので、翌1990年の4月まで待ってもらえませんか、というお願いの手紙をタイプライターで打って航空便で送った。Adrianが給料を払ってくれると言うから、学振PDの二年目の給料と研究費(奨励研究)は捨ててもいいと思った(外国で使えるのを知ったのは後日であった)。返事はすぐに来た。全然問題ありません、来年の4月まで待ちますとのこと。採択されたばかりのNIHグラントの応募書も同封されてきたので、スプライシング研究の歴史と現状がよくわかった。日本の科研費と違ってNIHグラントの研究計画の記述は行間一行で25ページもあって、微に入り細に入り研究内容を書かないといけないのだ。事務手続き上、CV(履歴書)とLetter(推薦状)を送ってくれと言う。大島先生はもちろん、当時、ワシントン大学から帰国され大島研の助手になられた森郁恵さん(現、名古屋大学・教授)と、同じく助手だった谷時雄さん(現、熊本大学・教授)、大島先生の前任、関口睦夫教授の助手だった清水憲二先生(現、岡山大学・名誉教授)が、快く推薦状を書いてくださった。清水先生は以前にコールドスプリングハーバー研究所のWigler研に留学されていた。
■最初のヒト・スプライシング蛋白質因子であるSF2/ASF(SRSF1)をめぐる壮絶な競争
予定通り1990年4月11日、大きなスーツケース一つでコールドスプリングハーバー研究所に到着した。研究所はLab Houseと称する一戸建ての家を、研究所周辺に何軒も保有しており、独身のポスドクや若手研究者はすぐに入居することができるようになっていた。家の台所や応接間は共用し、三、四部屋ある寝室をポスドクが使うわけである。私は、研究所のすぐ近く(歩いても約10分)の小高い丘の上にあった農場の中の一軒家に住むことになった。とにかく、研究環境の素晴らしさを実感するのに時間はかからなかった。研究所が家政婦さんを雇っていて、定期的にLab Houseに来て、部屋の掃除やベッドメークまでしてくれるのだ。「雑用はやらずに、どうぞ研究だけに専念しなされ」、と言わんばかりだ。まあアメリカに留学した経験のある人だとわかると思うが、一般的に研究のサポートは日本と比べものにならない。ささいなことだが、実験室の掃除やゴミ出しを始め、器具洗いはすべて専属の職員が行うのが当たり前。実験を始めて間もない頃、皆が使っているインキュベータの水槽が汚いので、流しできれいに掃除していたら、皆に不思議な顔をされた。遠心機など大型の実験機器は、大きな部屋に集めてあり、故障したら、学内で雇われている技術者がすぐに来て修理してくれた。また、写真を撮り、図を書いて、スライドやポスターを作ってくれる専門職員がいた。日本人は何でも自分でやる訓練ができているわけで、ある時に私が自分で図を作っていると、ボスが言うには「お前は図も書けるけどサイエンスもできる。彼らは、図を書くがサイエンスはできない。彼らに任せ、サイエンスに専心した方がいい」、と言われた。なるほど、おっしゃる通りで合理的だ。一事が万事、とにかく研究に対する徹底したサポート体制が整っていた。余談になるが、コールドスプリングハーバー研究所に留学して間もない5月16日〜20日に開催されたRNA Processing Meetingには、留学されていた大野睦人さん、井上丹さんも参加され、また大島研助手で先輩である谷時雄さん、志村先生も研究室の人(すなわち親しい友人たち)を連れて来られて、立派なスプライシングの研究成果を発表された。皆さんと、とても楽しい一時を過ごしたのは言うまでもない(図8)。

図8 1990年5月のRNA Processing Meetingで記念写真。上左から、大野睦人さん(当時、ロックフェラー大学・Blobel研)、井上丹さん(当時、ソーク研究所)、下左から、谷時雄さん(当時、九州大学・大島研)、私、Roberts研に短期滞在されていた宮原美知子さん(当時、国立衛生試験所)、志村令郎先生(当時、京都大学理学部)、澤斉さん(当時、京都大学・志村研)、井上邦夫さん(当時、京都大学・志村研)。
当時、スプライシングには5種類のU snRNP(U1、U2、U4/6、U5)が必須であることはようやくわかってきたが、U snRNPの構成蛋白質以外の蛋白質因子は、まったく知られていなかった。HeLa細胞核抽出液を調製する時、遠心により沈殿と上清に分ける段階があるが、スプライシング活性のある核抽出液はこの沈殿から塩溶出によって作られる(図9左)。一方、上清からはS100抽出液と呼ばれる細胞質抽出液が副産物としてできるが、このS100抽出液には核から漏れ出した5種類のU snRNPをすべて含むにも関わらず、スプライシング活性がない(図9右)。Adrianは、このS100抽出液に注目し、何かスプライシングに必須な蛋白質因子が欠けているに違いないと仮説を立て、その蛋白質因子の生化学的な精製を試みていた。Adrianから聞いた話であるが、ハーバード大学で院生時代の指導教官Tom Maniatis教授は分子生物学者であり、生化学的な精製手法は詳しくなく、彼は自分で勉強したり、他の研究室の生化学者から教えてもらったりして、自分からやり始めたようだ。

図9 HeLa細胞核抽出液とスプライシング活性。β-グロビンmRNA前駆体を使ったin vitroスプライシングで、S100抽出液はスプライシング活性がないが、欠けている必須因子を精製し同定したらSF2蛋白質(正確にはSR蛋白質)だったわけだ。
私が彼の研究室に加わった時には、この精製が成功し、33 kDaの蛋白質因子を同定、SF2(後にSF2/ASFあるいはASF/SF2、現在ではSRSF1に統一されている)と名づけて、私が渡米する直前に、その論文をGenes Dev.誌に投稿していた(Krainer et al. 1990a)。また、SF2の興味深い活性として、5′スプライス部位の選択に関わっていることも見いだしていた。すなわち、複数の5′スプライス部位を持つmRNA前駆体を用いたin vitroスプライシングの実験で、核抽出液では上流の遠位5′スプライス部位が使われやすいのに対し、SF2を加えると、下流の近位5′スプライス部位が使われ始める現象である(図10)。この発見も、同時期にCell誌に論文を投稿中であり、Adrianは毎日郵便受けを気にしていた(当時はまだ印刷物で論文の査読と連絡が行われていたのだ)。
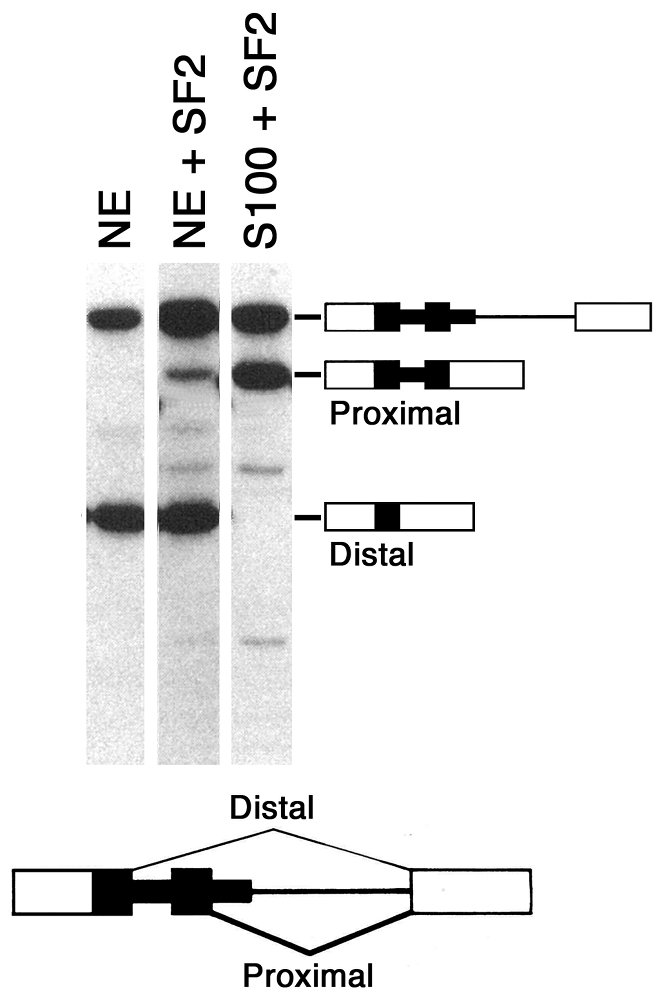
図10 5′スプライス部位を重複させたβ-グロビンmRNA前駆体のin vitroスプライシング。抽出液によって、遠位(Distal)と近位(Proximal)の5′スプライス部位の使われ方が違う(Krainer et al. 1990b)。
話はややこしくなるが、このSF2因子と後に同一の因子であることが判明するASFをコロンビア大学のJim Manleyが、ほぼ同時期に同定しており、2つの選択的5′スプライス部位を持つSV40ウイルスのmRNA前駆体基質を用いて、やはりASFが近位5′スプライス部位の選択活性をもつことを見つけていた。ただ、JimはあくまでASFは選択的スプライシング調節因子と信じていて、AdrianがS100抽出液で証明していたSF2のスプライシング必須性に対してはしばらく懐疑的であった。この事件から、Adrian KrainerとJim Manleyは、(スプライシング業界で知らない人はいない)永遠の宿敵となるわけである。宿敵だけど、仲はいいというライバルもいるが、彼らは公私にわたり、犬猿の仲であった。Meeting 会場での二人の激しい口論は、聴衆にとっては、「・・・喧嘩、犬をも食わず」の雰囲気であった。論文はCellの同一号に前後して掲載された(Ge & Manley 1990; Krainer et al. 1990b)。両者が事前に直談判したのだ。この頃には、SF2とASFはどうやら同じ因子だと両者とも確信していたので、その後の遺伝子クローニング、リコンビナント蛋白質での再現実験をはじめ、SF2/ASFにまつわるあらゆる研究は、激烈な競争になったことはいうまでもなく、このような状況で私はKrainer研に入ったわけである。
当時、独立したばかりのAdrianの研究室は、彼とテクニシャンDianeと最初のポスドクとなった私の3人で始まった。当然のことながらAdrianも私も朝から晩までベンチで実験していた(図11)。彼がHeLa細胞から精製したSF2のペプチド配列の情報からSF2をクローニングすると、SF2はN末にRNA-recognition motif(RRM)と呼ばれていた既知のRNA結合配列、C末には特徴的なアルギニンとセリンの繰り返し配列(RSドメイン)があり、U1 70K蛋白質やショウジョウバエのスプライシング調節因子といった既知のスプライシング因子と類似性があった。いよいよこのクローニングされたcDNAでリコンビナント蛋白質を作り、精製ヒトSF2でのスプライシング活性を再現しないといけない。この戦いに、戦士として私は駆り出されたのだ。SF2とASFは同じ因子だから、蛋白質構造も活性も同じに決まっている。お互いに論文を先に出し抜かれたくない。またもやJimとの事前協議で、論文を書いたら同時にCellに投稿する、という約束を交わしていた。

図11 研究室で再会したAdrian Krainerと私。渡米した4月初旬は、まだ肌寒く、彼がすぐにスーパーマーケットに連れて行ってくれ、そこで買ったパーカーを着ている。2人は同い年で、この時31歳(1958年生まれ)。
相手がどれくらい実験が進んでいるか、もちろん聞けるわけがない。予想がつかない状況での実験は気が気ではない。その上、大腸菌でSF2 cDNAを発現させたリコンビナントSF2蛋白質は、S100抽出液に加えてのスプライシング活性をなかなか示してくれなかった(図9右)。マルトース結合蛋白質のタグがついたリコンビナントSF2を調製したが、まったく活性なし。こんな緊迫した状況であるにも関わらず、Adrianは非常に楽天的で、決してプレッシャーをかけてこなかった。実験を頼む時も、「Akilaがもし時間が許して興味があるなら、やってみてください」、というクソ丁寧な言いぶりだった。こういう人は、競争の激しいアメリカでは珍しい。アメリカの第一線の研究室は大概アグレッシブで、ポスドクには毎日声をかけ、しょっちゅう呼び出し、あれこれ指図するボスが多いが、彼は真逆である。もっとも彼は生粋のアメリカ人ではない。彼の両親はヨーロッパ出身で、ユダヤ人だったのでナチスに追われ南米ウルグアイに亡命、そこで彼が生まれた。よって母国語はスペイン語、高校でも英語教科はなかったそうだ。私塾ではじめて英語を習って、アメリカに来たのは大学(コロンビア大学)の学部学生としてだから、結構苦労してきたに違いない。「艱難汝を玉にす」、なのだろうか、とにかく人格は丸かった。最初の頃、英会話をしていて、わかっていないような顔をしていると、必ずやさしい表現に言い換えて、ゆっくり話してきた。こういうアメリカ人は稀であろう。
さて、こういう緊迫した時期のある日、こともあろうに、彼は家族旅行に行くと言うではないか。「こんな状況でやばくないですか」、と進言したら、「いや、これは前々から計画していた旅行だから」と言って、実験のことは何も言わずに一週間ほど出かけてしまった。その後、二人で2ヶ月近く、試行錯誤を繰り返し、四苦八苦。結局SDS-ポリアクリルアミド電気泳動のゲルからSF2蛋白質を溶出し、一度グアニジンで変性させて、透析で徐々に未変性状態に戻す方法で、やっと活性のあるリコンビナントSF2が得られ、論文の図を作ることができた。Adrianは、喜んですぐに論文執筆に取りかかり、1991年5月に、約束通りJimと示し合わせてCellに投稿した。このタイミング、Manley研でもちょうど良かったのか、あるいは彼らは待ったのか、今となっては知るよしもない。またもや、同じ号に前後して論文が掲載された(Geet al. 1991; Krainer et al. 1991)。終始楽天的なAdrianにやきもきしたが、結果オーライで、胸をなで下ろした。
ほぼ同時期にハーバード大学のManiatis研のポスドクXiang-Dong Fuが、スプライシング複合体(スプライソソーム)に対するモノクローナル抗体を使って、別のスプライシングの蛋白質因子SC35を同定していた(Fu & Maniatis 1990)。クローニングされると、この分子もN末にRRM、C末にRSドメインを持つことがわかり(Fu & Maniatis 1992)、SF2/ASFと同様な活性があるのではないかと予想した。Adrianの出身研究室ということもあり、すぐに共同研究して、S100抽出液を用いたスプライシング必須性と選択的5′スプライシング活性を調べたところ、案の定、SF2/ASFと同様な活性があることがわかった(Fu et al. 1992)。同時期に、Roth研は6種類のスプライシング因子SRp20(現在名、SRSF3)、SRp30a(SF2/ASFと同一、SRSF1)、SRp30b(SC35と同一、SRSF2)、SRp40(SRSF5)、SRp55(SRSF6)、SRp75(SRSF4)を一挙に精製、同定しており、SF2/ASFと同様なRRMとRSドメインの構造とスプライシング活性があったので、これら一群のスプライシング因子をSR蛋白質と呼ぶようになった(Mayeda et al. 1992; Zahler et al. 1992)。結局、SF2/ASFは最初のSR蛋白質だったわけである。SF2を最初に精製・同定してから二年、クローニングしてから一年で、この有様である。もしAdrianが六年間苦労してSF2を発見していなくても、他のSR蛋白質は、遅かれ早かれ発見されていただろう。最前線での競争は激烈で、成果の後先は紙一重であることを、身をもって実感した。
なぜ似たような構造のSR蛋白質が複数あるのだろう? この疑問に対しては、その後5、6年の研究で、SF2/ASFとSC35がスプライシングできるmRNA前駆体が違う実例を発見し、その基質特異性を決めているのは、RSドメインではなくRRMであることを明確に証明することができた(Chandler et al. 1997; Mayeda et al. 1999)。志村研からいただいたIgMのmRNA前駆体がなければ、この論文で示したエレガントな結果は得られなかったことを、付言しておきたい。
■選択的スプライシング調節因子としてのhnRNP A1の精製と同定
複数の5′スプライス部位を持つmRNA前駆体を用いてSF2の選択的スプライシング活性を確認するin vitroスプライシング実験で、奇妙な現象に気づいていた。核抽出液にSF2を加えると、遠位5′スプライス部位から近位5′スプライス部位のスイッチが不完全であるが、S100抽出液にSF2を加えたものでは、そのスイッチがほぼ完全で、遠位5′スプライス部位がほとんど使われなくなるのである(図10)。この事実から、核抽出液に存在して、S100抽出液に存在しない未知の因子が、SF2の近位5′スプライス部位選択活性を抑制していると予想できた。この因子(最初はAnti-SF2と呼んでいたが、抗体と紛らわしいので後日SF5と名付けた)を核抽出液から精製し、本体を明らかにしようというのが私自身の主たる研究課題であった。上記のようにリコンビナントSF2やSR蛋白質の実験のお手伝いも平行してやっていたが、Krainer研に来てから2ヶ月後の1990年6月には、このプロジェクトを開始していた。大島研でやりたくて、結局諦めざるを得なかったスプライシング因子の精製と同定ができるのが嬉しくて、意気揚々と実験をやりまくった。大島研の時には、ガラス管に樹脂をつめたお手製のクロマトグラフィー装置で精製したが、Krainer研の低温室には、AdrianがU snRNPやSF2の精製に使っていたPharmacia社(当時)のFPLC(高速液体クロマトグラフィー)装置があった。低温室に入り浸りの研究生活が始まった。
熱い情熱は、低温室で、文字通り冷たい仕打ちを受け続けた。SF5の精製は一筋縄ではいかなかったのだ。HeLa細胞核抽出液を、まず古典的な精製法である硫安による塩析を行い、0〜50%飽和の画分に遠位5′スプライス部位の促進活性を確認したまではよかったが(ちなみにSF2は50〜80%飽和の画分から精製された)、イオン交換クロマトグラフィーなどを用いるその後の精製がまったくうまくいかなかった。分離後の画分には活性が検出できなくなってしまうのだ。その後わかったことは、0〜50%硫安の画分は、rRNA、tRNA、snRNAなどRNAが多量に含まれていて、このRNAがイオン交換樹脂に対する結合や解離を阻害していると考えられた。Adrianと相談して、CsCl密度勾配遠心で分離してみようということになった。彼がManiatis研でsnRNPを精製するときに使った経験があったのだ。遠心後の分画で、RNAは密度の高いチューブの下方に分布し、RNAが少ない上層の画分にSF5活性を分離することができた。ところが、DEAE-セファロースやMonoQ、MonoSで精製すると、明確な活性が失われてしまった。複数の因子が関与していることも考え、再構成実験もしたがまったくうまくいかなかった。しかし疎水性相互作用クロマトグラフィーであるPhenyl-Superoseカラムを用いることがブレークスルーになり、解決の方向に向かっていった。CsCl密度勾配遠心を何度も繰り返して精製する材料を変え、またいろいろと条件を変えたりし、8回目のPhenyl-Superoseカラムにして初めて、強いSF5活性が3つの画分に現れた(図12下)。しかも、SDSゲル電気泳動で調べると、その3つの画分に約35 kDaの太いバンドがあり、他の蛋白質はほとんど含まれていなかった(図12上)。実は前の段階のCsCl密度勾配遠心のSDSゲル分析によって、hnRNP A/Bの典型的なバンドパターンが観察されたので、その約35 kDa蛋白質はおそらくhnRNP A1であると察していた。抗hnRNP A1抗体を使ってウエスタンブロッティングを行うと、予想通りhnRNP A1であった! 一件落着、プロジェクトを始めて、1年近く経過した1991年5月13日のことであった。最初の仮説通り、hnRNP A1は核抽出液に多く存在して、S100抽出液にほとんど存在しないことも、ウエスタンブロッティングで見事に検証できた。
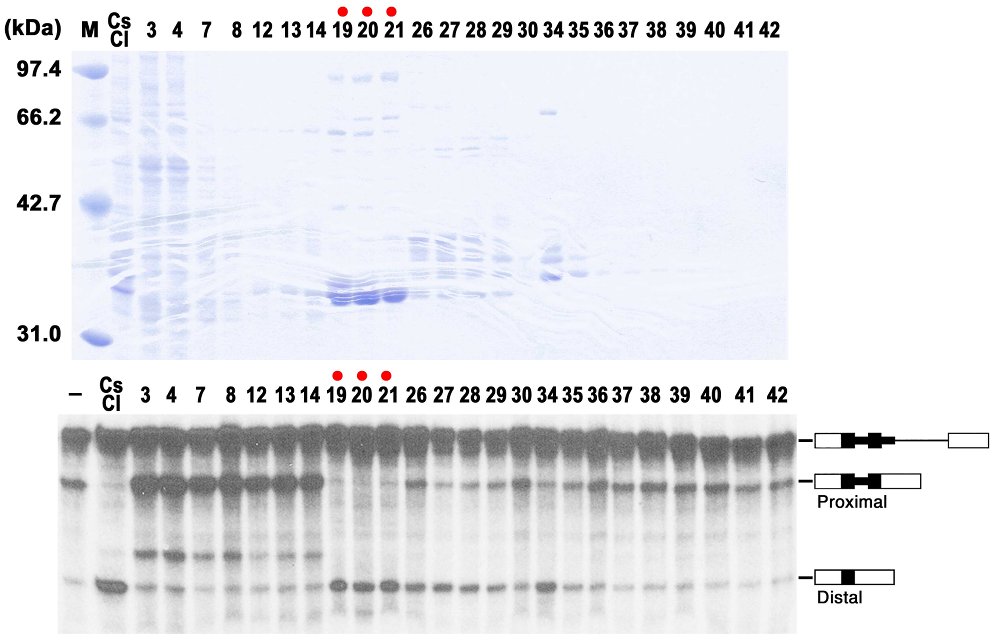
図12 Phenyl-Superoseカラムクロマトグラフィーを用い、塩の逆濃度勾配で溶出した画分のSDS-アクリルアミド電気泳動(上図)。赤丸を打った19〜21番目の画分に〜35 kDaの蛋白質が溶出し、そこに強いSF5活性(遠位5′スプライス部位選択活性)があった(下図)。使用したmRNA前駆体基質は図10と同じ。
このような生化学的な精製は、分子生物学の実験と違い、プロトコールがない。試行錯誤の末に成功して、それがプロトコールになるのだ。活性が途中でなくなってしまったら、また粗抽出液の調製からやり直し、精製法と条件を変えて試してみる。とにかく、成功するまで、際限なく執拗にSF5活性に狙いを定め、どこまでも追い続ける。自分で言うのもおかしいが、相当に執念深い性格でないとやっていけない。SF5が女性ならやばいことになる。しかし、苦労も大きいだけに、精製の最後の最後で、追っていた活性が一本のバンドになったあかつきには、悦楽の境地、至福の極みに至るのだ。だから研究は病みつきになり、やめられないのだ。これも対象が違えば・・・。研究者でよかった。
この一世一代の発見のまさに直後、1991年5月15日からのRNA Processing Meetingでは、AdrianがSF2のクローニングの話を口頭発表し、私は、まだホカホカ湯気が立っているSF5の成果をポスター発表することになった。まだ論文にしていないので、hnRNP A1なんて口が裂けても言えない。Adrianは神経質になっていた。SF5の本体がJim Manleyにばれるとまずい。いつもSF2/ASFで同じ成果を論文に同時発表してきたから、今度こそ、画期的成果で出し抜きたいという魂胆である。Adrianは、「蛋白質の大きさを35 kDaと言ってSDSゲルを見せたら、Jimを始め、目ざとい連中はhnRNP A1と気づくかもしれない。Akila、奴らには約40 kDaと言って、覚られないようにごまかそう。35 kDaと40 kDaはゲル上で少差だから差障りはないやろ(図12上を参照)」、と言い出した。案の定、宿敵Jimは私のポスターを見て、並々ならぬ関心を抱き、「Akilaが見つけた40 kDaはASF/SF2遺伝子の選択的スプライシングによるアイソフォーム蛋白質かもしれない」、と私に言ってきた。当時、JimはASF/SF2遺伝子のクローニングで、このASF/SF2の選択的スプライシングによるアイソフォーム蛋白質に関心を寄せていた。Adrianはシメシメと思ったかも知れないが、私自身は、少々誤った情報でこれからJimがしゃかりきになってASF/SF2アイソフォームの選択的スプライシング活性を調べるのが気の毒に思え、少々後ろめたかった。「坊主憎けりゃ袈裟まで憎い」と言うが、私はAdrianの袈裟ではないのでJimに嫌われたくない。
RNA Processing Meetingが終わって、いよいよ論文を書かないといけない。実は、hnRNP A1が怪しいとなった2月頃に、AdrianはNIHのSammuel Wilsonという研究者から、ちゃっかりとリコンビナントhnRNP A1蛋白質をもらっていた。私が調べて見ると、選択的スプライシング活性は確かにあったが、おそらく濃度や品質の問題で、精製したヒトhnRNP A1と比べてかなり活性が弱かった。私は「確かに活性があったから良しとして、これで論文を急ぎましょう」、とAdrianに進言すると、「ダメだぁ〜、これではトップ・ジャーナルではRejectを食らう〜!」、と言って、すぐにPCRを使って自分でhnRNP A1をクローニングし始めた。大腸菌発現のリコンビナントhnRNP A1の精製は、私にとって朝飯前だった。散々苦労して確立したヒトhnRNP A1蛋白質の精製法がそのまま使えたからだ。この自家製のリコンビナントhnRNP A1で、選択的スプライシング活性を調べると、何とヒトhnRNP A1と変わらない強い活性があった! めでたし、めでたし、で早速論文を書いた。RNA Processing Meetingでの発表から半年たち、11月になっていた。
あうんの呼吸で、科学雑誌の最高峰、泣く子も黙るNatureのArticleに投稿する、と相成った。査読はよかったが、何もわからない編集者がまっとうな理由なく、短くしてLetterにしろ、と言ってきた。短くなんかしてやるか、と意気投合、Natureを蹴って、Cellに出そう、と即断。Cellに投稿すると、重大な批判はほとんどなく、少々の書き直しで受理されそう。面白いことが起きた。当時は、査読結果も書類で送ってきたが、査読者の1人のレポートに、本来は著者には見せずに切り取る部分の、1(最低)〜10(最高)の総合評価が誤って含まれていた。査読者は、5(←If artefact)、10(←If not!)、と書き込んでいた。Artefactだったらアカンやろう、と突っ込みを入れたくなったが、たいそう好意的な査読をしてもらって感謝! もちろん、「This was not artefact」。年が明けた1992年1月24日号に論文が掲載された(Mayeda & Krainer 1992)。この論文のタイトルは一般性があり、先見の明があった。後々の研究で、SF2/ASF(SRSF1)とhnRNP A1蛋白質は、スプライシング・エンハンサーとスプライシング・サイレンサーの主役となるのだ。私たちは、その特徴的な一つの現象を最初に発見したことになる。今度のCellの号は、やっとJim Manley論文抜きだ。
(続く)
参考文献
Chandler, S.D., Mayeda, A., Yeakley, J.M., Krainer, A.R. & Fu, X.D. (1997) RNA splicing specificity determined by the coordinated action of RNA recognition motifs in SR proteins. Proc. Natl. Acad. Sci. USA 94, 3596-3601.
Dignam, J.D., Lebovitz, R.M. & Roeder, R.G. (1983) Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res. 11, 1475-1489.
Fu, X.D. & Maniatis, T. (1990) Factor required for mammalian spliceosome assembly is localized to discrete regions in the nucleus. Nature 343, 437-441.
Fu, X.D. & Maniatis, T. (1992) Isolation of a complementary DNA that encodes the mammalian splicing factor SC35. Science 256, 535-538.
Fu, X.D., Mayeda, A., Maniatis, T. & Krainer, A.R. (1992) General splicing factors SF2 and SC35 have equivalent activities in vitro, and both affect alternative 5' and 3' splice site selection. Proc. Natl. Acad. Sci. USA 89, 11224-11228.
Ge, H. & Manley, J.L. (1990) A protein factor, ASF, controls cell-specific alternative splicing of SV40 early pre-mRNA in vitro. Cell 62, 25-34.
Ge, H., Zuo, P. & Manley, J.L. (1991) Primary structure of the human splicing factor ASF reveals similarities with Drosophila regulators. Cell 66, 373-382.
Krainer, A.R., Conway, G.C. & Kozak, D. (1990b) The essential pre-mRNA splicing factor SF2 influences 5' splice site selection by activating proximal sites. Cell 62, 35-42.
Krainer, A.R., Conway, G.C. & Kozak, D. (1990a) Purification and characterization of pre-mRNA splicing factor SF2 from HeLa cells. Genes Dev. 4, 1158-1171.
Krainer, A.R. & Maniatis, T. (1985) Multiple factors including the small nuclear ribonucleoproteins U1 and U2 are necessary for pre-mRNA splicing in vitro. Cell 42, 725-736.
Krainer, A.R., Maniatis, T., Ruskin, B. & Green, M.R. (1984) Normal and mutant human β-globin pre-mRNAs are faithfully and efficiently spliced in vitro. Cell 36, 993-1005.
Krainer, A.R., Mayeda, A., Kozak, D. & Binns, G. (1991) Functional expression of cloned human splicing factor SF2: homology to RNA-binding proteins, U1 70K, and Drosophila splicing regulators. Cell 66, 383-394.
Lerner, M.R., Boyle, J.A., Mount, S.M., Wolin, S.L. & Steitz, J.A. (1980) Are snRNPs involved in splicing? Nature 283, 220-224.
Mayeda, A., Hayase, Y., Inoue, H., Ohtsuka, E. & Ohshima, Y. (1990) Surveying cis-acting sequences of pre-mRNA by adding antisense 2'-O-methyl oligoribonucleotides to a splicing reaction. J. Biochem. 108, 399-405.
Mayeda, A. & Krainer, A.R. (1992) Regulation of alternative pre-mRNA splicing by hnRNP A1 and splicing factor SF2. Cell 68, 365-375.
Mayeda, A. & Krainer, A.R. (2012) In vitro splicing assays. In: Alternative pre-mRNA splicing: Theory and protocols (eds. S. Stamm, C. Smith & R. Lührmann), pp. 321-329. Weinheim, Germany: Wiley-Blackwell.
Mayeda, A. & Ohshima, Y. (1988) Short donor site sequences inserted within the intron of β-globin pre-mRNA serve for splicing in vitro. Mol. Cell. Biol. 8, 4484-4491.
Mayeda, A. & Ohshima, Y. (1990) β-globin transcripts carrying a single intron with three adjacent nucleotides of 5' exon are efficiently spliced in vitro irrespective of intron position or surrounding exon sequences. Nucleic Acids Res. 18, 4671-4676.
Mayeda, A., Screaton, G.R., Chandler, S.D., Fu, X.D. & Krainer, A.R. (1999) Substrate specificities of SR proteins in constitutive splicing are determined by their RNA recognition motifs and composite pre-mRNA exonic elements. Mol. Cell. Biol. 19, 1853-1863.
Mayeda, A., Tatei, K., Kitayama, H., Takemura, K. & Ohshima, Y. (1986) Three distinct activities possibly involved in mRNA splicing are found in a nuclear fraction lacking U1 and U2 RNA. Nucleic Acids Res. 14, 3045-3057.
Mayeda, A., Zahler, A.M., Krainer, A.R. & Roth, M.B. (1992) Two members of a conserved family of nuclear phosphoproteins are involved in pre-mRNA splicing. Proc. Natl. Acad. Sci. USA 89, 1301-1304.
Ruskin, B., Krainer, A.R., Maniatis, T. & Green, M.R. (1984) Excision of an intact intron as a novel lariat structure during pre-mRNA splicing in vitro. Cell 38, 317-331.
Will, C.L. & Luhrmann, R. (2011) Spliceosome structure and function. Cold Spring Harb Perspect Biol 3, a003707.
Zahler, A.M., Lane, W.S., Stolk, J.A. & Roth, M.B. (1992) SR proteins: a conserved family of pre-mRNA splicing factors. Genes Dev. 6, 837-847.
Zhuang, Y. & Weiner, A.M. (1986) A compensatory base change in U1 snRNA suppresses a 5' splice site mutation. Cell 46, 827-835.






